
分析 方案一:在金属活动性顺序中,只有排在氢前的金属可以和稀酸溶液(除稀硝酸外)反应生成氢气,只有前面的金属可以把排在它后面的金属从盐溶液中置换出来,根据这一规律可以判断反应的发生或根据反应的发生判断金属的活动性强弱;
方案二:金属冶炼的本质是金属离子得电子被还原为单质,所以利用铝的强还原性,比较铁铝的还原性.
解答 解:方案一:根据现有药品,设计实验方案证明铝、铁金属单质的还原性,可利用在金属活动性顺序中,只有排在氢前的金属可以和稀酸溶液(除稀硝酸外)反应生成氢气,只有前面的金属可以把排在它后面的金属从盐溶液中置换出来,铝排在铁的前面,所以可用铝从铁的盐溶液中置换出,反应为2Al+3FeCl2=2AlCl3+3Fe,
故答案为:2Al+3FeCl2=2AlCl3+3Fe;
方案二:氧化铁和铝粉在高温条件下发生铝热反应生成铁和氧化铝,反应的化学方程式为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,铝为还原剂,铁为还原产物,在氧化还原反应中,还原剂的还原性强于还原产物的还原性,
故答案为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
点评 本题为实验题,明确金属活泼性强弱判断依据,熟悉铁、铝的性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
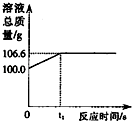 将一定量的CO2通入100g氢氧化钠溶液中恰好完全吸收,形成不饱和溶液,该溶液总质量与反应时间的变化关系如图.试分析解答:
将一定量的CO2通入100g氢氧化钠溶液中恰好完全吸收,形成不饱和溶液,该溶液总质量与反应时间的变化关系如图.试分析解答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与O2 | B. | NaOH与CO2 | C. | Ca(OH)2与NaHCO3 | D. | Na2O2 与CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 |  |  |  |
| 现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3 | B. | PCl3 | C. | NO3- | D. | BCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质代号 | A | B | C | D |
| 晶体类型 | 离子晶体 | 原子晶体 | 分子晶体 | 金属晶体 |
| 相应的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
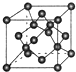 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com