
| A. | 加入氯水振荡,观察水层是否有棕红色溴出现 | |
| B. | 滴入AgNO3溶液,再加入稀硝酸呈酸性,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 |
分析 检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,据此即可解答.
解答 解:A.氯水与溴乙烷不反应,不能检验,故A错误;
B.溴乙烷不能电离出溴离子,加AgNO3溶液不反应,故B错误;
C.加入NaOH溶液,加热,卤代烃在碱性条件下水解生成溴化钠和醇,冷却,加入稀HNO3酸化后加入AgNO3溶液,溴离子和银离子反应生成淡黄色不溶于硝酸的溴化银沉淀,故C正确;
D.没有加硝酸中和多余的氢氧化钠,氢氧化钠与硝酸银能反应生成沉淀,产生干扰,故D错误.
故选C.
点评 本题考查了卤代烃中卤素的检验,题目难度不大,侧重于考查学生的分析能力和实验探究能力,依据卤代烃及卤离子的性质来解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③⑥ | C. | ③⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
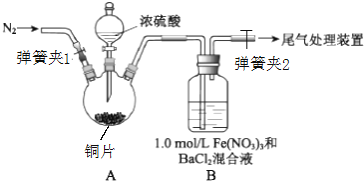
| 实验步骤(简述操作过程) | 预期现象和结论 |
| ①测1.0mol/L Fe(NO3)3溶液的pH ② ③ ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a-n=b+m | B. | 氢化物HnX或XHn | C. | a+n=b-m | D. | 化合物YnXm |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| B. | 每一周期的元素都是从碱金属开始,以稀有气体结束 | |
| C. | 最外层电子数为2的元素都位于第ⅡA族 | |
| D. | 在已经发现的元素中,金属元素种类比非金属元素多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
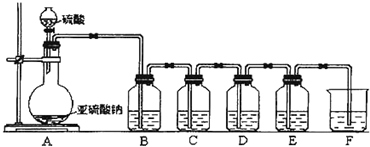
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
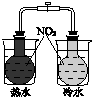 | 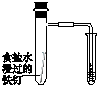 | 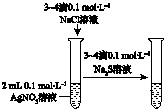 | 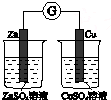 |
| 验证温度对平 衡移动的影响 | 验证铁 发生析氢腐蚀 | 验证AgCl 溶解度大于Ag2S | 验证化学能 转化为电能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:KOH>Ca(OH)2>Mg(OH)2 | ||
| C. | 稳定性:HCl<H2S<PH3 | D. | 原子半径:Na<Mg<Al |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去 | |
| B. | 由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分 | |
| C. | 乙醇能与乙酸在一定条件下反应生成乙酸乙酯和水,说明乙醇具有碱性 | |
| D. | 由于乙醇容易挥发,所以才有熟语“酒香不怕巷子深”的说法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com