
(15��)������ˮ��������Ⱦ��������Ҫ���⡣��ˮ�и�Ԫ����Cr2O72-��CrO42-��ʽ���ڣ������������������ǣ�
��1���������ʹCrO42-ת��ΪCr2O72-�� 2CrO42- + 2H+ Cr2O72- + H2O
Cr2O72- + H2O
��������pH=1��Һ��Cr2O72-Ũ��Ϊ0��1 mol?L-1��Cr2O72-Ũ����CrO42-Ũ�ȵ�10�����û�ѧƽ�ⳣ��K= ��
��2�����۸��Ķ��Դ�Լ�����۸���100������������ԭ������������Һ��ͨSO2��Cr2O72-��ԭ����Ӧ�����ӷ���ʽΪ �������ټӼCr3+��������֪������Ksp��Cr(OH)3�� =10-32,Ҫʹc(Cr3+)���͵�10-5mol?L-1����Һ��pHӦ���ߵ� ��
��3����ԭ�������õ�������Fe2+��Cr2O72-��ԭΪCr3+�����װ�����õĵ缫������̼������Ƭ��������Ƭ����ֱ����Դ�� ����
��4��Cr(OH)3Ϊ��ɫճ�Գ�����������Al(OH)3����������������ǿ����Һ��Cr(OH)3����ϡ����Ļ�ѧ����ʽΪ ����100��00mL 0��1000 mol?L-1CrCl3��Һ�μ�1��000mol?L-1NaOH��Һ, �뻭�����ɳ��������ʵ��������NaOH��Һ����Ĺ�ϵͼ: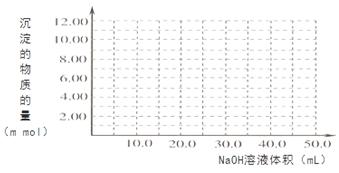
��1����1��0��105��2��3SO2 + Cr2O72- + 2H+ = 2Cr3+ + 3SO42- + H2O 5
��3�� ����4�� 2Cr(OH)3 + 3H2SO4 = 2Cr2(SO4)3 + 3H2O��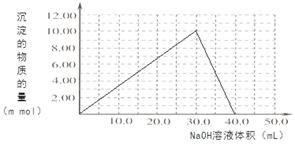 ��
��
���������������1����ѧƽ�ⳣ�� ����2����������Һ��ͨSO2��Cr2O72-��ԭΪCr3+�����ݵ����غ㼰����غ㡢ԭ���غ�ɵ÷�Ӧ�����ӷ���ʽΪ3SO2 + Cr2O72- + 2H+ = 2Cr3+ + 3SO42- + H2O��������Ksp��Cr(OH)3�� =10-32, c(Cr3+)=10-5mol/L,c3(OH-)=10-32��10-5=10-27������c(OH-)=10-9mol/L����c(H+)=Kw��c(OH-)=10-5mol/L,���pH=5����3����ԭ�������õ�������Fe2+��Cr2O72-��ԭΪCr3+�����װ�����õĵ缫������̼������Ƭ��������Ƭ��Ҫʧȥ���ӱ�ΪFe2+������ƬҪ���Դ���������ӡ�Cr(OH)3��ϡ���ᷴӦ��ѧ����ʽΪ2Cr(OH)3 + 3H2SO4 = 2Cr2(SO4)3 + 3H2O��n(Cr3+)=0��1L��0��100mol/L=0��01mol�������Һ�м���NaOH���ȷ�����Ӧ��Cr3����3OH-��Cr(OH)3����n(NaOH)= 0��03mol����NaOH�����Ϊ30mlʱ�����ﵽ���ֵ���ټ���NaOH��Һ��������Ӧ��Cr(OH)3+ OH-= CrO2-+ 2H2O����ʱ������NaOH�����ʵ���Ϊ0��01mol,��������10ml�����ﵽ40mlʱ��������ȫ�ܽ⡣֮���ٵμ�NaOH��Һ��Ҳ���ᷢ����Ӧ�����ɳ��������ʵ��������NaOH��Һ����Ĺ�ϵͼΪ
����2����������Һ��ͨSO2��Cr2O72-��ԭΪCr3+�����ݵ����غ㼰����غ㡢ԭ���غ�ɵ÷�Ӧ�����ӷ���ʽΪ3SO2 + Cr2O72- + 2H+ = 2Cr3+ + 3SO42- + H2O��������Ksp��Cr(OH)3�� =10-32, c(Cr3+)=10-5mol/L,c3(OH-)=10-32��10-5=10-27������c(OH-)=10-9mol/L����c(H+)=Kw��c(OH-)=10-5mol/L,���pH=5����3����ԭ�������õ�������Fe2+��Cr2O72-��ԭΪCr3+�����װ�����õĵ缫������̼������Ƭ��������Ƭ��Ҫʧȥ���ӱ�ΪFe2+������ƬҪ���Դ���������ӡ�Cr(OH)3��ϡ���ᷴӦ��ѧ����ʽΪ2Cr(OH)3 + 3H2SO4 = 2Cr2(SO4)3 + 3H2O��n(Cr3+)=0��1L��0��100mol/L=0��01mol�������Һ�м���NaOH���ȷ�����Ӧ��Cr3����3OH-��Cr(OH)3����n(NaOH)= 0��03mol����NaOH�����Ϊ30mlʱ�����ﵽ���ֵ���ټ���NaOH��Һ��������Ӧ��Cr(OH)3+ OH-= CrO2-+ 2H2O����ʱ������NaOH�����ʵ���Ϊ0��01mol,��������10ml�����ﵽ40mlʱ��������ȫ�ܽ⡣֮���ٵμ�NaOH��Һ��Ҳ���ᷢ����Ӧ�����ɳ��������ʵ��������NaOH��Һ����Ĺ�ϵͼΪ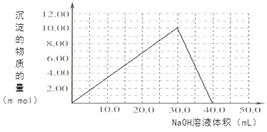 ��
��
���㣺���黯ѧ�����ܽ�ƽ�⡢ƽ�ⳣ���ļ��㡢��������������Ӧ�ļ����֪ʶ��


 ��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д� �����������Ż�ѧϰϵ�д�
�����������Ż�ѧϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ȡ����п�ۣ��ֱ�ʢ�ڼס��ҡ�����֧�Թ��У�������Ҫ���������ʺ��������ӣ���ʱ�ⶨ�������������������50 mL pH��3�����ᣬ�Ҽ���50 mL pH��3�Ĵ��ᣬ������50 mL pH��3�Ĵ��ἰ����������ĩ������Ӧ���ˣ��������������һ���࣬��û��ʣ���п�����á����������������ش����и��⡣
��1����ʼʱ����Ӧ���ʵĴ�СΪ ��
��2����֧�Թ��вμӷ�Ӧ��п������Ϊ ��
��3����Ӧ���ˣ�����ʱ��Ϊ ��
��4���ڷ�Ӧ�����У��ҡ������ʲ�ͬ��������(��Ҫ˵��) ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
CO2�������г����Ļ�����֮һ���������繤ҵ���õķ�չ���˿ڵľ�����ȫ����Դ���ż�������������Խ��Խ���ص����⣬�����CO2�������о����ۺ������������ӡ�
���ڴ��������£����ɼ״���CO2ֱ�Ӻϳ�̼�������(DMC)��CO2 + 2CH3OH �� CO(OCH3)2 + H2O�����״�ת����ͨ�����ᳬ��1%��������Լ�÷�Ӧ����ҵ������Ҫԭ��ij�о�С���������������������£�ͨ���о��¶ȡ���Ӧʱ�䡢���������ֱ��ת����(TON)��Ӱ�������۴����Ĵ�Ч�������㹫ʽΪ��TON��ת���ļ״������ʵ���/���������ʵ�����
��1�����ݷ�Ӧ�¶ȶ�TON��Ӱ��ͼ����ͬʱ���ڲⶨ�����жϸ÷�Ӧ���ʱ��H________0�����������������������������____________________________________��

��2�����ݷ�Ӧʱ���TON��Ӱ��ͼ����ͼ������֪��Һ�����10mL����Ӧ��ʼʱ�״�0.25mol������0.6��10��5 mol��������¶��£�4��7 h��DMC��ƽ����Ӧ���ʣ�________��
��3�����ݸ��о�С���ʵ�鼰����������TON��Ӱ��ͼ��������ͼ�����ж�����˵����ȷ���� ��
A���ɼ״���CO2ֱ�Ӻϳ�DMC���������ü״���Ӱ�컷������������CO2 ת��Ϊ��Դ������Դѭ�����úͻ����������涼������Ҫ����
B. �ڷ�Ӧ��ϵ�����Ӻ��ʵ���ˮ��������߸÷�Ӧ��TON
C. ��������������1.2��10��5 molʱ�����Ŵ������������ӣ��״���ƽ��ת�����������
D. ��������������1.2��10��5 molʱ�����Ŵ�������������DMC�IJ��ʷ��������½�
��.��������ڵ�CO2����˳���ų������������ж���������Һ���Ե������������������ҺpH��Ӱ�죬����ѪҺ����Ҫͨ��̼�����λ�����ϵ(H2CO3/HCO3-)ά��pH�ȶ�����֪��������ѪҺ����������ʱ��H2CO3��һ�����볣��Ka1=10-6.1��c(HCO3-):c(H2CO3)��20:1��lg2=0.3��
(4)��������ݿ������������ѪҺ��pH________(����һλС��)��
(5)��������ѪҺ��H2CO3��HCO3-��OH-��H+������Ũ���ɴ�С��ϵΪ�� ��
(6)���������ᡢ�����ѪҺ��ʱ��ѪҺpH�仯������ԭ�������������������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��17�֣�����̫����CO2��������Ч��������CO2���ǿ�ѧ���о�����Ҫ���⡣
��1����ȼú�����е�CO2ת��Ϊ�����ѵķ�Ӧԭ��Ϊ��
2CO2��g��+6H2��g�� CH3OCH3��g��+3H2O��g�� ��H=-122��4kJ��mol��1
CH3OCH3��g��+3H2O��g�� ��H=-122��4kJ��mol��1
��ij�¶��£���2��0molCO2��g����6��0molH2��g����������ɱ���ܱ������У���Ӧ����ƽ��ʱ���ı�ѹǿ���¶ȣ�ƽ����ϵ��CH3OCH3��g�������ʵ��������仯���±���ʾ��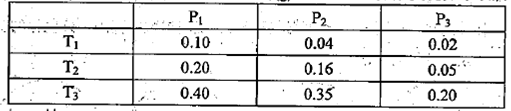
��Pl P3���>����<����=������ͬ������T1��Pl��T3��P3ʱƽ�ⳣ���ֱ�ΪK1��K3��
��K1 K3��T1��PlʱH2��ƽ��ת����Ϊ ��
��һ�������£�t������Ӧ���ܱ������д�ƽ�⡣�����ı�Ӱ�췴Ӧ��һ����������������б仯��˵��ƽ��һ��������Ӧ�����ƶ�����____ ��
A����Ӧ���Ũ�Ƚ��� B��������ѹǿ����
C������Ӧ���ʴ����淴Ӧ���� D����ѧƽ�ⳣ��K����
��2��̼�������Һ��ˮϡ�ͣ� ����������䡱��С��������̼�����Һ���տ�����CO2�����ܶɳ�����ʱ�����й�ϵ��˵����ȷ���� ��
����������䡱��С��������̼�����Һ���տ�����CO2�����ܶɳ�����ʱ�����й�ϵ��˵����ȷ���� ��
A��c��K+��=2c��CO ��+c��HCO
��+c��HCO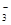 ��+c��H2CO3��
��+c��H2CO3��
b��c��HCO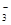 ��
�� c��CO
c��CO ��
��
c�������¶ȣ�c��H+����c��OH��������
��3����ʢ��FeCl3��Һ���Թ��еμ�����̼�����Һ�������������壬��Һ��ɫ����ü���������ܲ��������ЧӦ����Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
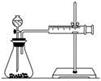
��16�֣�Ӱ�컯ѧ��Ӧ���ʵ����غܶ࣬ijУ��ѧС����ʵ��ķ�������̽����
ʵ��һ������ֻ����Cu��Fe��Mg�Ͳ�ͬŨ�ȵ�����(0.5 mol��L��1��2 mol��L��1��18.4 mol��L��1)���ʵ�鷽�����о�Ӱ�췴Ӧ���ʵ����ء���ͬѧ��ʵ�鱨�����±���
| ʵ�鲽�� | ���� | ���� |
| �ٷֱ�ȡ�������2 mol��L��1���������Թ��� | ��Ӧ����Mg>Fe��Cu����Ӧ | ����������Խ���ã���Ӧ����Խ�� |
| ��____________ | | ��Ӧ��Ũ��Խ��Ӧ����Խ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������16�֣����ʹ�����CO2�ĺ�������Ч�ؿ�������CO2����Ϊ�о�����Ҫ���⡣
��1����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H ����1275.6 kJ/mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H ����566.0 kJ/mol
�� H2O(g) �� H2O(l) ��H ����44.0 kJ/mol
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ�� ��
��2�����ݻ�Ϊ2L���ܱ������У�����2mol CO2��6mol H2�����¶�500��ʱ������Ӧ��
CO2��g��+ 3H2��g�� CH3OH��g��+ H2O��g�� ��H<0��CH3OH��Ũ����ʱ��仯��ͼ���ش��й����⣺
CH3OH��g��+ H2O��g�� ��H<0��CH3OH��Ũ����ʱ��仯��ͼ���ش��й����⣺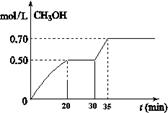
�ٴӷ�Ӧ��ʼ��20����ʱ��H2��ƽ����Ӧ����v(H2)��_________________��
�ڴ�30���ӵ�35���Ӵﵽ�µ�ƽ�⣬�ı������������ ��
A. ����ѹǿ B.������� C.�����¶� D.����Ӧ���Ũ��
����ʽ����÷�Ӧ��35���Ӵﵽ��ƽ��ʱ��ƽ�ⳣ��(����2λС��)
�������30����ʱ,���������г���2mol CO2��6mol H2�������¶Ȳ��䣬�ﵽ��ƽ��ʱ��CH3OH��Ũ��____________1mol.L-1(�>������<����=��)��
��3��һ��ԭ��صĹ���ԭ��Ϊ��2Na2S2 + NaBr3  Na2S4 + 3NaBr���øõ��Ϊ��Դ������������ˮ��Һ������ʽ��е�⣬ʹCO2��ͭ�缫�Ͽ�ת��Ϊ���顣
Na2S4 + 3NaBr���øõ��Ϊ��Դ������������ˮ��Һ������ʽ��е�⣬ʹCO2��ͭ�缫�Ͽ�ת��Ϊ���顣
�ٸõ�ظ����ĵ缫��ӦʽΪ�� ��
�ڵ����в���CH4һ���ĵ缫��ӦʽΪ�� ��
��4����ͼ��NaOH����CO2��ij�ֲ����ˮ��Һ��pH��0��14�ķ�Χ��H2CO3��HCO3����CO32�����ֳɷ�ƽ��ʱ����ɷ�����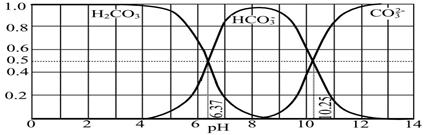
����������ȷ���� ��
A����ͼ��1.0 mol��L-1̼������Һ�ζ�1.0 mol��L-1 HCl��Һ�ĵζ�����
B����pH�ֱ�Ϊ6.37��10.25ʱ����Һ��c(H2CO3)=c(HCO3��)=c(CO32��)
C������ѪҺ��pHԼΪ7.4����CO2��ѪҺ�ж���HCO3����ʽ����
D������CO2��NaOH��Ӧ��ȡNaHCO3���˿�����Һ��pHΪ7��9֮��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(9��)��֪A(g)+B(g)  C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
| |�¶�/ �� | 700 | 900 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)��ƽ�ⳣ����ֵΪ ��
A(g)+B(g)��ƽ�ⳣ����ֵΪ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������;ʮ�ֹ㷺����ҵ�Ϻϳ�����ʱ����SO2ת��Ϊ��������һ���ؼ����衣��ش��������⣺
��1���÷�Ӧ�ں��º����ܱ������н��У��ж���ﵽƽ��״̬�ı�־��������������ĸ��
a��SO2��SO3Ũ�����
b��SO2�ٷֺ������ֲ���
c�������������ѹǿ����
d��SO3������������SO2�������������
e�������л��������ܶȱ��ֲ���
��2��ij�¶��£�2SO2(g)��O2(g�� 2SO3(g�� ��H����196 kJ?mol��1����һ���̶��ݻ�Ϊ5 L���ܱ������г���0.20 mol SO2��0.10 mol O2������Ӻ�ﵽƽ�⣬��������к�SO3Ϊ0.18 mol����v(O2)���� ��mol?L��1?min��1���ų�������Ϊ�� �� kJ��
2SO3(g�� ��H����196 kJ?mol��1����һ���̶��ݻ�Ϊ5 L���ܱ������г���0.20 mol SO2��0.10 mol O2������Ӻ�ﵽƽ�⣬��������к�SO3Ϊ0.18 mol����v(O2)���� ��mol?L��1?min��1���ų�������Ϊ�� �� kJ��
��3��һ���¶�ʱ��SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ��ʾ���Է�����ҵ�����в��ó�ѹ��ԭ������ ����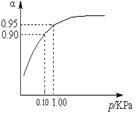
��4����һ������SO2��0.7 molO2����һ��������ܱ������У���550��ʹ��������·�����Ӧ����Ӧ�ﵽƽ��������еĻ������ͨ������NaOH��Һ���������������21.28 L���ٽ�ʣ������ͨ������ûʳ����ļ�����Һ����O2�����������ּ�����5.6 L(�������������Ϊ��״���µ����)����÷�Ӧ�ﵽƽ��ʱSO2��ת�����Ƕ��٣���Ҫд��������̣�����������һλС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�״���ͨ����ú�������������ɵ�CO��H2��һ�������£��������·�Ӧ�Ƶã�CO(g)��2H2(g)  CH3OH(g)�������ͼʾ�ش��������⣺
CH3OH(g)�������ͼʾ�ش��������⣺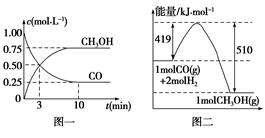
(1)�ӷ�Ӧ��ʼ��ƽ�⣬��H2Ũ�ȱ仯��ʾƽ����Ӧ����v(H2)�� ��CO��ת����Ϊ ��
(2)�÷�Ӧ��ƽ�ⳣ������ʽΪ ���¶����ߣ�ƽ�ⳣ�� (���������С�����䡱)��
(3)����һ����ɱ���ܱ������г���1 mol CO��2 mol H2��1 mol CH3OH���ﵽƽ��ʱ��û��������ܶ���ͬ��ͬѹ����ʼ��1.6�������������ʺ�÷�Ӧ�� (����������桱)��Ӧ�����ƶ��������� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com