
实验室制取少量N2常利用的反应是NaNO2+NH4Cl NaCl+N2↑+2H2O,关于该反应的说法正确的是
NaCl+N2↑+2H2O,关于该反应的说法正确的是
A.NaNO2是氧化剂
B.生成1molN2时转移的电子为6mol
C.NH4Cl中的N元素被还原
D.N2既是氧化剂又是还原剂
科目:高中化学 来源:2015-2016学年四川省高一上期中测试化学试卷(解析版) 题型:填空题
(1)写出下列反应的化学反应方程式,用双线桥标明电子转移数目和方向,并指出反应中的氧化剂、还原剂、氧化产物和还原产物。
氯酸钾制氧气: 。
氧化剂是 ,还原剂是 ,氧化产物 ,还原产物 。
(2)已知反应:
①MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O ②Cl2+SO2+2H2O=H2SO4+2HCl
1)反应①的离子方程式 ;
2)反应①中被氧化的HCl和未被氧化的HCl的物质的量之比为 ,有0.2 mol HCl被氧化,转移电子的数目是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏银川市高一上学期期中测试化学试卷(解析版) 题型:选择题
同温同压下,下列气体的密度最大的是
A .H2 B .Cl2 C .HCl D .CO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省台州市高二上学期第一次月考化学试卷(解析版) 题型:选择题
已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨) + O2(g)=CO2(g);△H=-393.51kJ ·mol-1
C(金刚石) + O2(g)= CO2(g);△H=-395.41kJ ·mol-1
据此判断,下列说法中正确的是
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
查看答案和解析>>
科目:高中化学 来源:2016届河南省顶级名校高三上学期期中测试化学试卷(解析版) 题型:选择题
据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生反应的化学方程式为:5KClO3+6P=3P2O5+5KCl,则下列有关叙述错误的是
A.上述反应是放热反应
B.该反应氧化剂与还原剂物质的量之比为6∶5
C.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
D.上述反应中消耗3molP时,转移电子的物质的量为15mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期第二次月考化学试卷(解析版) 题型:填空题
某二元酸(化学式用H2B表示)在水中的电离方程式H2B=H++HB-;HB- H++B2-回答下列问题:
H++B2-回答下列问题:
(1)Na2B溶液显______(填“酸性”,“中性”,或“碱性”)。理由是___________(用离子方程式表示)。
(2)在0.1 mol/L 的Na2B溶液中,下列粒子浓度关系式正确的是
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol/L NaHB溶液的pH=2,则0.1 mol/L H2B溶液中氢离子的物质的量浓度可能是____0.11 mol/L(填“<”、“>”、“=”)理由是: 。
(4)0.1 mol/L NaHB溶液中各种离子浓度由大到小的顺序是_____________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
对于可逆反应2SO2(g)+O2(g) 2SO3(g) ΔH<0,下列叙述正确的是
2SO3(g) ΔH<0,下列叙述正确的是
A.单位时间内生成2molSO3的同时消耗了1molO2,则反应到达平衡状态
B.升高温度反应速率增大,由于该反应是放热反应,V(逆)小于V(正),所以反应达到平衡的时间将延长
C.保持温度和密闭体系体积不变,起始加入2molSO2和1molO2,平衡后加入2molSO2和1molO2,重到达平衡时SO2的体积分数减小
D.该反应的化学平衡常数表达式为
查看答案和解析>>
科目:高中化学 来源:2016届四川省广元市高三上学期第三次段考理综化学试卷(解析版) 题型:填空题
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:N2O5(g) 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达平衡后,再通入一定量N2O5,则N2O5的转化率将_______。(填““增大”“减小”或“不变”);
②下表为反应在T1温度下的部分实验数据:
t/s | 0 | 500 | 1 000 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500s内N2O5的分解速率为_________________。
③在T2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2___________T1。
(2)下图所示装置可用于制备N2O5,则N2O5在电解池的_________区生成,其电极反应式为_________________。
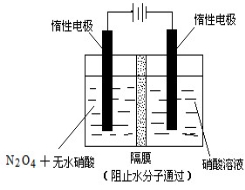
查看答案和解析>>
科目:高中化学 来源:2015-2016学年上海市高二上学期期中测试化学试卷(解析版) 题型:选择题
几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列叙述正确的是:
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com