
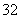 He可以作为核聚变材料。下列关于
He可以作为核聚变材料。下列关于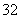 He叙述正确的是( )
He叙述正确的是( )
A.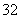 He和
He和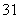 H互为同位素
H互为同位素
B.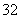 He原子核内中子数为2
He原子核内中子数为2
C.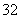 He原子核外电子数为2
He原子核外电子数为2
D.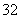 He代表原子核内有2个质子和3个中子的氦原子
He代表原子核内有2个质子和3个中子的氦原子
科目:高中化学 来源: 题型:
采用不同的分类方法,可将非金属氧化物分为不同的类别。例如从某种意义上可将P2O5、SO2、SO3、CO2、Cl2O7等归为一类,则下列氧化物与它们属于同一类的是( )
A.CO B. CaO C.N2O5 D.Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
Ⅰ.把氯气通入紫色石蕊试液中,可以观察到的现象是:
________________________________________________________________________。
请你解释其中的原因______________________________________________________
________________________________________________________________________。
Ⅱ.某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液。
(1)其反应原理为:(用化学方程式表示)____________________________________ ___________________________________________________________________________。
(2)实验室配制好4.0 mol·L-1的NaOH溶液,这种溶液________L才能与2.24 L氯气(标准状况)恰好完全反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组微粒中,核外电子层结构相同的是( )
A.Mg2+、O2-、Na+、F- B.Na+、F-、S2-、Ar
C.K+、Ca2+、S2-、Ba2+ D.Mg2+、S2-、Na+、F-
查看答案和解析>>
科目:高中化学 来源: 题型:
小明等同学为了探究酸、碱、盐溶液的导电性,设计了如下实验:
①在5只250 mL烧杯中分别加入浓度为0.1 mol·L-1的盐酸、CH3COOH溶液、NaOH溶液、NaCl溶液、氨水各150 mL。
②在5种溶液中分别放入相同规格的石墨电极,按下图连接好。
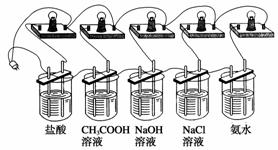
③接通电源,仔细观察现象。
现象1:五个灯泡都亮起来。
结论:_________________________________________________________________。
现象2:盐酸、氯化钠、氢氧化钠溶液对应的灯泡较亮,醋酸、氨水对应的灯泡较暗。
结论:__________________________________________________________________
________________________________________________________________________。
思考:
(1)酸、碱、盐溶液导电与金属导电的原理是否相同,为什么?
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
(2)同学们为了探究不同电解质之间电离能力的差异,设计了上述实验,通过观察灯泡的明亮程度,判断电解质的电离能力大小,为此必须控制其他能影响灯泡亮度的一些因素,使之保持一致,从而不影响灯泡的明亮程度。在本实验中,采取了哪些主要措施来控制其他因素对灯泡亮度的影响?(写出三条即可)_______________________________________
______________。
(3)小明同学根据现象2得出一个结论:氯化氢、氯化钠、氢氧化钠是强电解质,醋酸、一水合氨是弱电解质。你同意他这个观点吗?为什么?___________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(4)为了进一步探究氯化氢等化合物是强电解质,小红同学在老师的帮助下测定了0.1 mol·L-1的盐酸中的氢离子浓度,通过对结果的分析,即可得出结论。说明氯化氢是强电解质的理由是:测得溶液中的氢离子浓度________ 0.1 mol·L-1(选填“>”、“<”或“=”)。
(5)同学们在实验的基础上,进一步查阅资料得知:一般来说,________________
是强电解质,________________________________________是弱电解质。根据以上结论推测:如果将上述实验中的醋酸和氨水混匀,然后分别盛放在原来的烧杯中。接通电源,可以观察到的现象是________(填字母代号)。
A.与混合前无任何区别
B.5只灯泡都亮起来,亮度完全相同
C.只有盐酸、氯化钠、氢氧化钠溶液对应的灯泡亮起来,另外两只不亮
D.5只灯泡都亮起来,盐酸、氯化钠、氢氧化钠溶液对应的灯泡较亮,另外两只略暗,但明显比混合前明亮
查看答案和解析>>
科目:高中化学 来源: 题型:
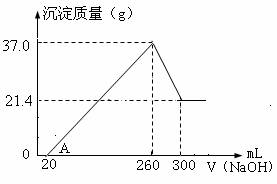
将Fe2O3 、Al2O3 两种固体混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
⑴A点坐标(20,0),0到A点的离子反应方程式为
⑵原混合物中Fe2O3的质量是 g
⑶所用NaOH溶液物质的量浓度为多少?
解题过程:
⑷稀硫酸物质的量浓度为多少?
解题过程:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com