
测得某浓度的![]() 溶液的pH=5,根据此数据作出如下结论,其中不合理的
溶液的pH=5,根据此数据作出如下结论,其中不合理的
[
]A.![]() 离子电离的趋势大于水解的趋势
离子电离的趋势大于水解的趋势
B.溶液中![]()
C
.此溶液pH小于D
.此溶液只能与强碱溶液反应,不能与强酸溶液反应科目:高中化学 来源:福建省永安一中2011-2012学年高二上学期期中考试化学试题 题型:022
(1)将4 mol SO2和2 mol O2充入2 L的密闭容器中,在一定条件下发生反应,经10 s后达到平衡,测得SO3的浓度为0.6 mol·L-1,请回答下列问题:
①用O2表示的反应的平均速率为________
②平衡时SO2的转化率________
③平衡时SO3的体积分数为________
④10 s时O2的浓度为________
(2)已知某可逆反应mA(g)+nB(g)![]() qC(g)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空
qC(g)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空

①化学计量数的关系:m+n________q;(填“>”、“<”或“=”)
②该反应的正反应为________反应.(填“吸热”或“放热”)
(3)在FeCl3+3KSCN![]() Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
(填“正向”、“逆向”、“不”)
①在溶液中加入少量的KSCN固体,平衡________移动.
②在溶液中加入少量的KCl固体,平衡________移动.
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省许昌新乡平顶山高三第一次调研考试理科综合试题(化学部分) 题型:实验题
(14分)二氧化硫和氮的氧化物是重要的化工原料,同时也是造成大气污染的主要物质。对其性质的研究是化学的重要任务。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_____。
②平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)N2O5在四氯化碳溶液中的分解反应为:2N2O5=4NO2+O2。实验测得在67℃时反应体系中N2O5的物质的量浓度随时间的变化如下表所示。
|
t/min |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(N2O5)/mol·L—1 |
1.00 |
0.71 |
0.50 |
0.35 |
0.25 |
0.17 |
①实验进行的前1分钟和最后1分钟,用N2O5的物质的量浓度变化表示的平均反应速率分别是 、 。
②实验进行的最后1分钟,用NO2的物质的量浓度变化表示的平均反应速率是 ;5分钟时NO2的物质的量浓度是 。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中放出的热量为____kJ。
查看答案和解析>>
科目:高中化学 来源:2010年黑龙江牡丹江一中高二上学期期中考试化学试卷 题型:实验题
Ⅰ.下列有关实验操作或结果的说法中正确的是 (填字母)
A.滴定时,眼睛应始终注视滴定管内液面的变化
B.用碱式滴定管量取0.10 mol·L-1的KMnO4溶液15.10 mL
C.酸碱中和滴定之前,锥形瓶用蒸馏水洗净即可,不能用待测液润洗
D.用pH试纸测量某溶液的pH时要先将试纸润湿
E.滴定管经蒸馏水洗净后,直接注入标准液,将使测得的待测液浓度偏高
F.用广泛pH试纸测量H2SO4溶液的pH时,测得pH=3.2
G.测定酸碱滴定曲线:开始时测试和记录的间隔可稍小些,滴定至终点附近则要大些
Ⅱ.(1)由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式 。已知H2O(l) = H2O(g) ΔH =+44 kJ·mol-1 则标准状况下33.6 L H2 生成液态水时放出的热量是 kJ。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷P4和P4O6的分子结构如下图所示:
现提供以下化学键的键能:P-P 198 kJ·mol-1 P-O 360 kJ·mol-1,氧气分子内氧原子间的(O=O)键能为498 kJ·mol-1。则P4+3O2 = P4O6的反应热ΔH为 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(08上海嘉定区期末)某化学课外兴趣小组探究铜与浓硫酸的反应情况。甲、乙、丙三位同学进行了下列实验:取12.8g铜片和20ml、18mol/L的浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余外,同时根据所学的知识认为还有较多的硫酸剩余。(1)请写出铜跟浓硫酸反应的化学方程式:______________________________
试问:为什么较多的余酸不再与铜片继续反应?简述理由:_______________________________________________________________。
可以证明有余酸的实验方案是________(填写字母,错选或多选扣分)
(a)再加入铁粉 (b)再滴入BaCl2溶液 (c)再加入银粉(d)再滴入Na2CO3溶液
(2)甲学生设计求余酸浓度的实验方案是测定产生气体的量。其方法有多种,请问下列方案中不可行的是________(填写字母,错选或多选扣分)
(a)将产生的气体缓缓通过预先称量盛有碱石灰的干燥管,结束反应后再次称量。
(b)将产生的气体缓缓通入酸性高锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀。
(c)用排水法测定其产生气体的体积(折算成标准状况)。
(d)用排饱和NaHSO3溶液的方法测出其产生气体的体积(折算成标准状况)。
(3)乙同学设计测定余酸浓度的实验方案是:测定反应后的混合液中Cu2+的量。在反应后的溶液中加蒸馏水稀释至100ml,加入足量Na2S溶液,充分反应后,过滤、洗涤、干燥、称量沉淀。请写出生成沉淀的离子方程式:___________________________________
(4)根据甲、乙两同学的实验方案,除测算产生气体的物质的量或反应掉的铜的物质的量外,尚缺少的测量数据是_________________________________。
(5)丙同学提出甲、乙两同学的实验方案设计的复杂,为此他设计了下列较为简易的实验方案:取出反应后的铜片,进行洗涤、干燥、称量。若称得剩余铜片的质量为Wg,测得
反应后溶液的体积为Vml,请计算剩余硫酸的物质的量浓度
=______________________mol/L(用含W、V的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)二氧化硫和氮的氧化物是重要的化工原料,同时也是造成大气污染的主要物质。对其性质的研究是化学的重要任务。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。根据图示回答下列问题:
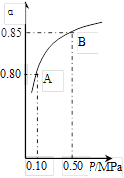
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_____。
②平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)N2O5在四氯化碳溶液中的分解反应为:2N2O5=4NO2+O2。实验测得在67℃时反应体系中N2O5的物质的量浓度随时间的变化如下表所示。
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/mol·L—1 | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①实验进行的前1分钟和最后1分钟,用N2O5的物质的量浓度变化表示的平均反应速率分别是 、 。
②实验进行的最后1分钟,用NO2的物质的量浓度变化表示的平均反应速率是 ;5分钟时NO2的物质的量浓度是 。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中放出的热量为____kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com