
【题目】碳元素在无机物和有机物中均充当了重要的角色,请回答下列问题:
(1)基态碳原子的价层电子排布图(轨道表达式)为__,其电子占据的能量最高的原子轨道的形状为__;C、N、O三种元素第一电离能最大的是__。
(2)有机物![]() 中碳原子的轨道杂化类型为__,分子中两种碳碳单键长的大小关系为①__②(填“>”、“<”或“=”)。
中碳原子的轨道杂化类型为__,分子中两种碳碳单键长的大小关系为①__②(填“>”、“<”或“=”)。
(3)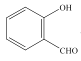 和
和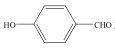 均可以形成氢键,则沸点较高的是__,原因是__。
均可以形成氢键,则沸点较高的是__,原因是__。
(4)石墨的结构及晶胞如图一所示,则石墨的密度为__g·cm-3(用含a、d、NA的表达式表示)。A的原子坐标为(![]() 、
、![]() 、0),则B的原子坐标为__。
、0),则B的原子坐标为__。
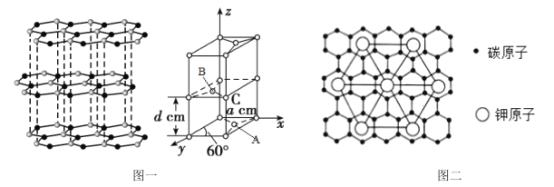
(5)石墨能与熔融的金属K作用,形成一种青铜色的化合物CxK,如图二所示,则x=__。
【答案】![]() 哑铃形 N sp2、sp3 >
哑铃形 N sp2、sp3 > ![]()
 形成的为分子内氢键,而
形成的为分子内氢键,而![]() 形成的为分子间氢键
形成的为分子间氢键 ![]() (
(![]() 、
、![]() 、
、![]() ) 8
) 8
【解析】
根据碳原子的价电子排布式写出排布图,判断电子占据的能量最高的原子轨道的形状;利用电离能的变化规律判断C、N、O三种元素第一电离能的相对大小;结合碳原子的价层电子对数目确定杂化轨道方式;分子间氢键强于分子内氢键;结合晶胞结构,采用均摊法确定晶胞的化学式。
(1)基态碳原子的价层电子排布式为2s22p2,则层电子排布图为![]() ,电子占据的能量最高的原子轨道为2p,其形状为哑铃形;C、N、O三种元素为同周期主族元素,第一电离能随核电荷数递增呈增大趋势,但N原子的2p轨道为半充满结构,相对稳定,不易失电子,其第一电离能大于O原子,则C、N、O三种元素第一电离能最大的是N;
,电子占据的能量最高的原子轨道为2p,其形状为哑铃形;C、N、O三种元素为同周期主族元素,第一电离能随核电荷数递增呈增大趋势,但N原子的2p轨道为半充满结构,相对稳定,不易失电子,其第一电离能大于O原子,则C、N、O三种元素第一电离能最大的是N;
(2)有机物![]() 中甲基碳原子价层电子对数为4,则为sp3杂化,而碳碳双键上碳原子,价层电子对数目为3,无孤对电子,则为sp2杂化;碳碳单键②介于两个碳双键间,易形成共轭大π键,则碳碳单键①的键长大于碳碳单键②的键长;
中甲基碳原子价层电子对数为4,则为sp3杂化,而碳碳双键上碳原子,价层电子对数目为3,无孤对电子,则为sp2杂化;碳碳单键②介于两个碳双键间,易形成共轭大π键,则碳碳单键①的键长大于碳碳单键②的键长;
(3) 主要形成分子内氢键,而
主要形成分子内氢键,而![]() 主要形成分子间氢键,其中分子间氢键的作用力明显大于分子间氢键,则
主要形成分子间氢键,其中分子间氢键的作用力明显大于分子间氢键,则 的沸点比
的沸点比 高;
高;
(4)石墨晶胞底边长为acm,则底面积为acm×acm×sin60°,层间距为dcm,晶胞高为d cm,则晶胞体积= acm×acm×sin60°×2dcm,晶胞中碳原子数目=1+8×![]() +4×
+4×![]() +2×
+2×![]() =4,晶胞质量=
=4,晶胞质量=![]() g,密度=
g,密度= =
=![]() g/cm3;x轴、y轴的角平分线与z轴构成的平面将晶胞平分为2个三棱柱,B位于三棱柱的中心,B、C距离等于晶胞底面菱形长对角线长度的
g/cm3;x轴、y轴的角平分线与z轴构成的平面将晶胞平分为2个三棱柱,B位于三棱柱的中心,B、C距离等于晶胞底面菱形长对角线长度的![]() , A位于三棱柱底面的中心,则由A的原子坐标为(
, A位于三棱柱底面的中心,则由A的原子坐标为(![]() 、
、![]() 、0)可知,则B的原子坐标为(
、0)可知,则B的原子坐标为(![]() 、
、![]() 、
、![]() );
);
(5)石墨能与熔融的金属K作用,形成一种青铜色的化合物CxK,由图二可知,正六边形中K原子数目为6![]() +1=3,碳原子位于正六边形的内部,共有24个,则x=
+1=3,碳原子位于正六边形的内部,共有24个,则x=![]() =8。
=8。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】活动小组同学用下图1装置进行实验,试回答下列问题。
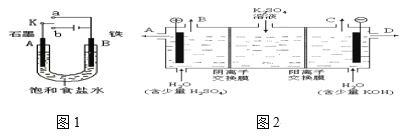
(1)若开始时开关K与a连接,则A极的电极反应式为____。
(2)若开始时开关K与b连接,则A极的电极反应式为____。
(3)当开关K与b连接时,关于这个实验,下列说法正确的是(填序号)____。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①制得的氢氧化钾溶液从出口(填“A”、“B”、“C”、“D”)___导出,制得的氧气从出口(填“A”、“B”、“C”、“D”)___导出。
②此时通过阴离子交换膜的离子数___(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
③通电开始后,阴极附近溶液pH会增大,请简述原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)写出下列仪器的名称:
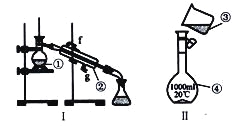
①__________________;②__________________;④__________________;
(2)仪器①~④中,使用时必须检査是否漏水的有_______________(填序号〉
(3)现需配制250 mL0.2mol/LNaCl溶液,装置II是某同学转移溶液的示意图,图中两处错误是_____________,___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含amol金属钠和bmol金属铝的合金投入mg足量水中,完全溶解,无金属剩余,所得溶液密度为dgcm﹣3,下列相关计算式子中错误的是( )
A.NaOH的物质的量:(a﹣b)mol
B.NaAlO2的物质的量浓度:![]() mol/L
mol/L
C.标况下生成H2的体积:![]() L
L
D.参加反应的水的质量:18(a+1.5b)g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某兴趣小组根据课本实验设计的一个能说明Na2CO3与NaHCO3热稳定性的套管实验。请观察下图的实验装置、分析实验原理,下列说法错误的是( )
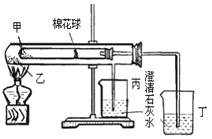
A. 甲为小苏打,乙为纯碱
B. 要证明NaHCO3受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C. 整个实验过程中可以看到丙烧杯的澄清石灰水没变浑浊
D. 同质量的甲和乙分别与足量的盐酸完全反应,产生二氧化碳的质量:乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量之比为( )
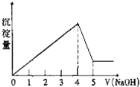
A. 1:1B. 2:1C. 3:1D. 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。回答下列问题:
(1)D2+的价层电子排布图为_____。
(2)四种元素中第一电离最小的是____,电负性最大的是____。(填元素符号)
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
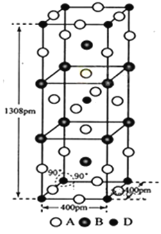
①该化合物的化学式为_____________;D的配位数为_______;
②列式计算该晶体的密度为___________g·cm-3。(列式并计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
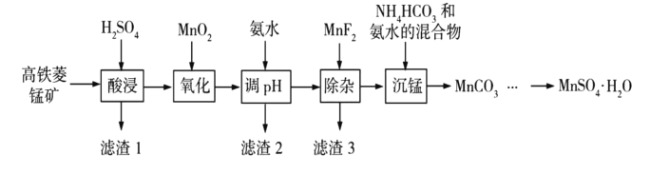
【题目】![]() 在工业、农业等方面有广泛的应用,工业上可由高铁菱锰矿(主要成分为
在工业、农业等方面有广泛的应用,工业上可由高铁菱锰矿(主要成分为![]() ,含有
,含有![]() 等杂质)制备,部分工艺流程如下:
等杂质)制备,部分工艺流程如下:
相关金属离子生成氢氧化物沉淀的![]() 如表(开始沉淀的
如表(开始沉淀的![]() 按离子浓度为
按离子浓度为![]() 计算):
计算):
金属离子 |
|
|
|
|
|
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
(1)“氧化”时发生反应的离子方程式为___________;
(2)“调pH”范围至5~6,得到滤渣2的主要成分除![]() 外还有___________;
外还有___________;
(3)“除杂”过程中加入![]() 的目的是___________;
的目的是___________;
(4)“沉锰”过程中发生反应的化学方程式为___________;
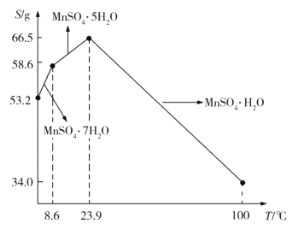
(5)![]() 在水中的溶解度与温度的关系如图所示。由
在水中的溶解度与温度的关系如图所示。由![]() 获得较纯净的
获得较纯净的![]() 晶体的方法是:将
晶体的方法是:将![]() 溶于适量的稀硫酸,控制温度在80℃~90℃之间蒸发结晶,__________(填操作名称),得到
溶于适量的稀硫酸,控制温度在80℃~90℃之间蒸发结晶,__________(填操作名称),得到![]() 晶体,洗涤、烘干。晶体通常采用减压烘干的原因是__________;
晶体,洗涤、烘干。晶体通常采用减压烘干的原因是__________;
(6)已知:![]() 。室温下,若溶液中
。室温下,若溶液中![]() ,欲使溶液中的
,欲使溶液中的![]() ,则需调节溶液pH范围为______________________。
,则需调节溶液pH范围为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入Y溶液中,生成沉淀物质的量n2与所加X的物质的量n1的关系如图所示。符合图所示情况的是
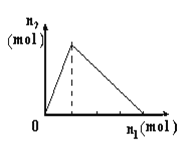
A | B | C | D | |
X | NaOH | AlCl3 | HCl | NaAlO2 |
Y | AlCl3 | NaOH | NaAlO2 | HCl |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com