
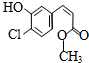
| A. | 该有机物的摩尔质量为200 | |
| B. | 该有机物属于芳香烃 | |
| C. | 该有机物可发生取代、加成、加聚、氧化、还原、消去反应 | |
| D. | 1 mol该有机物在适当条件下,最多可与4mol NaOH和4mol H2反应 |
分析 该分子中含有氯原子、酚羟基、酯基、碳碳双键,具有氯代烃、酚、烯烃和酯的性质,能发生水解反应、取代反应、氧化反应、还原反应、加成反应等,据此分析解答.
解答 解:A.摩尔质量的单位是g/mol,该有机物的摩尔质量为200g/mol,故A错误;
B.该有机物中除了含有C、H元素之外还含有O元素,所以属于烃的含氧衍生物,故B错误;
C.该有机物中不能发生消去反应,故C错误;
D.酯基水解生成的羧基、酚羟基、氯原子能和NaOH溶液反应,苯环和碳碳双键能和氢气发生加成反应,所以1 mol该有机物在适当条件下,最多可与4mol NaOH和4mol H2反应,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,易错选项是D,注意氯原子取代之后生成的HCl能和NaOH反应,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
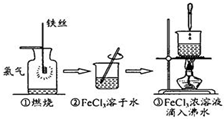
| A. | 实验①、③反应制得的物质均为纯净物 | |
| B. | 实验②、③均未发生氧化还原反应 | |
| C. | 实验②、③均为放热反应 | |
| D. | 实验①、②所涉及的物质均为电解质或非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
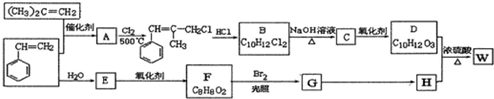
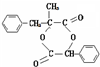 .
.  ;由D生成高分子化合物的方程式为
;由D生成高分子化合物的方程式为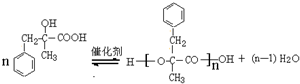 .
.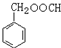 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 0.01mol/L NaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度/ ℃ | 溶液变蓝所用 时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
| 实验步職(不要求写出具体搡作过程) | 预期实验现象和结论 |
| 在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲); 在烧杯乙中预先加入少量Na2SO4粉末,其他条件与甲完全相同,进行同一反应, 用速率检测仪测定其起始阶段相同时间内的反应速率v(乙). | 若v(甲)=v(乙) 则假设一不成立 若v(甲)<v(乙),则假设一成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(B)>r(C)>r(D) | |
| B. | B的简单气态氢化物的热稳定性比D的弱 | |
| C. | E分别与A、C形成的化合物中化学键类型相同 | |
| D. | C的最高价氧化物对应水化物的碱性在同周期中最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向漂白粉中滴入60%的硫酸,产生黄绿色气体,说明硫酸具有还原性 | |
| B. | 实验室中将海带中的I-完全氧化为I2时,宜选用H2O2作氧化剂而不用HNO3 | |
| C. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此BaSO4沉淀不可能转化为BaCO3沉淀 | |
| D. | 25℃时,100mLpH=13的Ba(OH)2溶液中OH-的物质的量为0.02 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
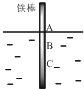 将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )
将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )| A. | 铁棒AB段发生反应为O2+4e-+2H2O=4OH- | |
| B. | 腐蚀过程中在铁棒上会产生微电流,且方向是AB段到BC段 | |
| C. | 向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响 | |
| D. | 产生这种现象的本质原因是铁棒所处的化学环境不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
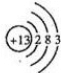
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com