
【题目】某固定体积的密闭容器中,加入—定量的A达化学平衡: aA(g)![]() B(g)+c(g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是
B(g)+c(g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是
A. 若a=b+c时,B的物质的量分数变大 B. 若a=b+c时,B的物质的量分数不变
C. 若a>b+c时,A的转化率不变 D. 若a<b+c时,A的转化率变大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中发生可逆反应:mA(g)+nB(g)![]() pC(g)+qD(g),当m、n、p、q为任意整数(不为零)时,一定能说明达到平衡状态的标志是( )
pC(g)+qD(g),当m、n、p、q为任意整数(不为零)时,一定能说明达到平衡状态的标志是( )
A. 各组分的浓度不再改变
B. 体系的压强不再改变
C. 反应速率vA:vB:vC:vD=m:n:p:q
D. 单位时间内m mol A断键发生反应,同时n mol B也断键发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.需要加热的反应一定是吸热反应
B.所有的化学反应都有能量变化
C.所有的放热反应都可以在常温常压下自发进行
D.核能作为一种反应热,是理想的新能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于著名科学家的国籍、名字和研究成果的对应关系中,正确的是( )
A.英国道尔顿﹣﹣﹣﹣提出元素概念
B.法国拉瓦锡﹣﹣﹣﹣提出原子学说
C.俄国门捷列夫﹣﹣﹣发现元素周期律
D.英国波义耳﹣﹣﹣﹣建立燃烧现象的氧化学说
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如图所示:
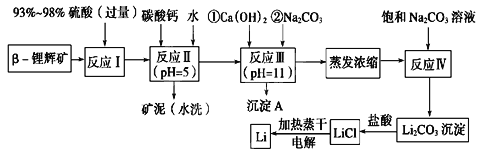
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH如下表:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:________________________。
(2)反应Ⅱ加入碳酸钙的作用是___________________。
(3)流程中两次使用碳酸钠溶液,请说明前后两次使用中浓度不同的原因:______________。
(4)洗涤所得Li2CO3沉淀要使用________(填“热水”或“冷水”),你选择的理由是________________。
(5)将盐酸与Li2CO3完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂。电解时产生的氯气中会混有少量氧气,原因是:__________________________。
(6)下列关于金属锂及碱金属的说法正确的是___________(填序号)。
A.锂是碱金属,其熔点高于钠 B.根据对角线原则,氢氧化锂是强碱
C.金属锂的氧化物形式十分复杂 D.碱金属中密度最小的是锂,其次是钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有0.270 kg 质量分数为10 %的CuCl2溶液。计算:
(1)溶液中Cu2+ 和Cl-物质的量。
(2)若该溶液密度为1.08 g/mL,则CuCl2的物质的量浓度是多少?
(3)若取该溶液100 mL,加入铁片(过量),充分反应后对铁片洗涤、烘干、称重,铁片质量增加多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应 a A(g)![]() b B(g)+c C(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的70%,以下不正确的是( )
b B(g)+c C(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的70%,以下不正确的是( )
A. 平衡向正反应方向移动了
B. 物质A的转化率减少了
C. 物质B的质量分数增加了
D. a<b+c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com