
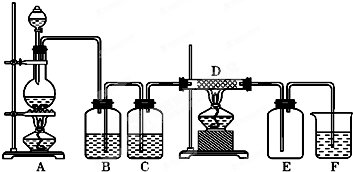
 如图所示,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.
如图所示,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.分析 二氧化锰与浓盐酸在加热条件下生成氯气和氯化锰和水,浓盐酸易挥发制取的氯气中含有氯化氢和水,依据氯气和氯化氢的水溶性选择合适的除杂剂,浓硫酸具有吸水性,可以干燥氯气,干燥的氯气与铁反应生成氯化铁,氯气有毒,应进行尾气吸收,氯气能够与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,据此解答.
解答 解:(1)二氧化锰与浓盐酸在加热条件下生成氯气和氯化锰和水,浓盐酸易挥发制取的氯气中含有氯化氢和水,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以B中盛有饱和食盐水,可以除去氯气中的氯化氢,洗气时,应长进短出;
故答案为:B;处除去氯气中的氯化氢;
(2)制备的氯气中含有水蒸气,浓硫酸具有吸水性,能够干燥氯气;
故答案为:浓硫酸;干燥氯气;
(3)铁与氯气反应生成氯化铁,方程式:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
故答案为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了氯气的制备及性质检验,明确氯气制备原理和各装置作用是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
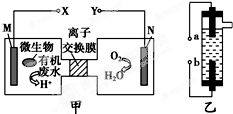
| A. | 装置甲可以在高温环境中工作 | |
| B. | 装置甲中N极发生的电极反应为O2+4H++4e-═2H2O | |
| C. | 装置乙中b极的电极反应式为2H++2e-═H2↑ | |
| D. | 装置乙的a极要与装置甲的Y极连接 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x<y | B. | x=y | C. | x>y | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
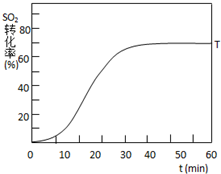 根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料.
根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在下面的装置中,A是Cl2发生装置,C、D为气体的净化装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.试回答:
在下面的装置中,A是Cl2发生装置,C、D为气体的净化装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
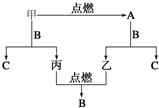 甲、乙、丙三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体,它们之间的转化关系如图所示.
甲、乙、丙三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体,它们之间的转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
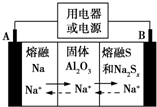 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )| A. | 放电时,电极A为负极,Na+由B向A移动 | |
| B. | 放电时,负极反应式为2Na-xe-═2Na+ | |
| C. | 充电时,电极B的反应式为S2--2e-═xS | |
| D. | 充电时,电极B接电源的负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com