
高铁酸钾(K2FeO4)是一种绿色高效水处理剂。某学习小组用下图所示装置(夹持仪器已略去)制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备K2FeO4。

查阅资料知K2FeO4的部分性质如下:①可溶于水、微溶于浓KOH溶液;②在0℃~5℃、强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。请回答下列问题:
(1)装置A中发生反应的化学方程式为 。
(2)仪器C和D中都盛有KOH溶液,其中C中KOH溶液的作用是 。
(3)Cl2与KOH的浓溶液在较高温度下反应生成KClO3。为保证反应生成KClO,需要将反应温度控制在0~5℃下进行,在不改变KOH溶液浓度的前提下,实验中可以采取的措施是 。
(4)在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中即可制取K2FeO4,写出该反应的化学方程式 ;该操作不能将KClO饱和溶液滴加到Fe(NO3)3饱和溶液中,其原因是 。
(5)制得的粗产品中含有Fe(OH)3、KCl等杂质。提纯方案:将一定量的K2FeO4粗产品溶于冷的3 mol/LKOH溶液中,用砂芯漏斗(硬质高硼玻璃)过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,再用砂芯漏斗过滤,晶体用适量乙醇洗涤2~3次后,在真空干燥箱中干燥。
①第一次和第二次过滤得到的固体分别对应的是(填化学式) 、 ,过滤时不用普通漏斗而采用砂芯漏斗的原因是 。
②晶体用乙醇洗涤的原因是 。
科目:高中化学 来源:2016-2017学年辽宁省高二上开学测化学试卷(解析版) 题型:填空题
在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g) + H2O(g)  CO2(g) + H2(g)△H<0。CO和H2O(g)浓度变化如右图
CO2(g) + H2(g)△H<0。CO和H2O(g)浓度变化如右图
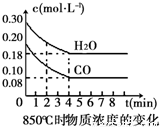
(1)0~4min的平均反应速率v(CO)=___________mol•L-1•min-1.
(2)该条件下,此反应的平衡常数K=___________(写表达式).
(3)该反应平衡时CO的转化率为________________。
(4)能判断该反应达到化学平衡状态的依据是______________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表.

① c1数值___________0.08mol•L-1(填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能的原因是________________,表中5min~6min之间数值发生变化,可能的原因是_______________。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上开学测化学试卷(解析版) 题型:选择题
某元素X的最高价含氧酸的化学式为HnXO2n-2,则在其气态氢化物中,X元素的化合价为( )
A. 3n-6 B. 5n-12 C. 3n-12 D. n-10
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三第一次摸底化学试卷(解析版) 题型:实验题
过氧化钙较稳定,不溶于乙醇,微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。

回答下列问题:
(1)大理石经过溶解、沉淀、过滤、在沉淀、再过滤,得到CaCO3,其目的是 ;过滤需要用到的玻璃仪器主要有漏斗、烧杯和 。
(2)反应①的具体操作作为逐滴加入稀盐酸,至溶液中尚存有少量固体。将溶液煮沸,趁热过滤。将溶液煮沸的作用是 。
(3)反应②的化学方程式为 ,该反应需要在冰浴下进行,原因是 。
(4)白色晶体水洗时,判断是否洗净的方法是 ;使用乙醉洗涤的目的是 。
(5)制备过氧化钙的另一种方法是:将石灰石锻烧后.直接加人双氧水反应,过滤后可得到过氧化钙产品。该法的优点是工艺简单、操作简单.所得产品的缺点是 。
(6)CaO2·8H2O加热脱水的过程中,需不断通入氧气.目的是抑制过氧化钙分解。若通入的氧气中混有二氧化碳,其后果是 ;已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。

若所取产品质量为ag,测得生成气体的体积为VmL(已换算成标准状况),则产品中CaO2的质量分数为 (用含a、V的式子表示)。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-)
B.0.1mol/L醋酸钠溶液20ml与0.1mol/L盐酸10ml混合后的溶液中:c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
C.物质的量浓度相等的①NH4Cl、②(NH4)2SO4、③NH4Al(SO4)2三种溶液中,c(NH4+)由大到小的顺序为:③>②>①
D.浓度为0.1mol/L的①氨水、②C6H5ONa溶液、③Na2CO3溶液、④NaHCO3溶液,pH的大小顺序:①>④>③>②
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.若1mol Na2O2与足量水反应后产生氧气,理论上转移的电子数为2×6.02×1023
B.0.1mol/L Na2CO3溶液加热后,溶液的pH减小
C.室温下稀释0.1mol/L CH3COOH溶液,溶液的导电能力减弱,因此溶液中所有离子浓度均减小
D.向废水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进Fe3+水解
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期摸底化学试卷(解析版) 题型:选择题
下列叙述正确的有几项
①氯化钠溶液能导电,所以氯化钠溶液是电解质
②BaSO 4 投入水中,导电性较弱,故它是弱电解质
③氯化氢水溶液能导电,所以氯化氢是电解质
④三氧化硫溶于水能导电,所以三氧化硫是电解质
⑤铜能导电,所以是电解质
⑥CaCO 3 投入水溶液几乎不能导电,但CaCO 3 是强电解质
⑦氯气溶于水能导电所以氯气为电解质
A.1 B.2 C .3 D. 4
查看答案和解析>>
科目:高中化学 来源:2017届新疆生产建设兵团二中高三上第一次月考化学试卷(解析版) 题型:填空题
铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用.CeO2在稀硫酸和H2O2的作用下可生成Ce3+,写出该反应的化学方程式__________________,CeO2在该反应中作__________剂。
(2)自然界中Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬.写出过程中的离子方程式:________________。
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是_________________。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下:
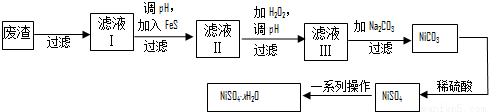
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________。
②对滤液Ⅱ先加H2O2再调pH,加H2O2的目的是_____________,调pH的目的是____________。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com