

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
分析 废铁屑中含少量氧化铝、氧化铁等,将过量废铁屑加入稀硫酸中,发生反应 Fe+H2SO4=FeSO4+H2↑、Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4,然后反应I中加入NaHCO3并搅拌,调节溶液的pH,发生反应Al3++3HCO3-=Al(OH)3↓+3CO2↑,所以滤渣中成分是Al(OH)3,过滤得到硫酸亚铁,向硫酸亚铁溶液中加入稀硫酸和NaNO2,酸性条件下,NaNO2和FeSO4发生氧化还原反应生成铁离子、NO,将溶液蒸发浓缩、过滤得到碱式硫酸铁,据此分析解答.
(1)要制备硫酸亚铁,应与硫酸铝分离,根据沉淀的pH选择;
(2)酸性条件下,反应Ⅱ中加入NaNO2,将亚铁氧化成铁离子,为下一步制取碱式硫酸铁提供铁离子;
(3)所消耗氧气得到的电子的物质的量相当于NaNO2得到电子的物质的量;
(4)[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒书写水解反应的离子方程式.
解答 解:(1)制备硫酸亚铁,应与硫酸铝分离,应调节溶液pH生成Al(OH)3,要避免生成应Fe(OH)2沉淀,根据氢氧化物沉淀需要的pH知,在pH在4.4-7.5之间将铝离子转化为Al(OH)3沉淀,而亚铁离子不能生成沉淀,所以控制pH在4.4~7.5之间,
故答案为:4.4~7.5;Al3+;
(2)酸性条件下,亚硝酸钠具有氧化性,能将亚铁离子氧化为铁离子,自身被还原生成NO,所以反应Ⅱ中加入NaNO2的目的是氧化Fe2+,发生反应的离子方程式为 2H++Fe2++NO2-=Fe3++NO↑+H2O,
故答案为:氧化Fe2+;2H++Fe2++NO2-=Fe3++NO↑+H2O;
(3)1molNaNO2被还原生成NO,化合价由+3价降低到+2价,得到1mol电子,1mol氧气得到电子1mol×4=4mol,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),反应过程中提供电子相等,则相当于节约NaNO2的物质的量=$\frac{11.2L}{\frac{22.4L/mol}{1}}×4$=2mol,
故答案为:2mol;
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为 2Fe(OH)2++2H2O?Fe2(OH)42++2H+,
故答案为:2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
点评 本题考查制备原理的设计,题目难度中等,注意根据物质的性质和题给信息判断可能发生的反应,方程式的书写为解答该题的难点,也是易错点,注意体会书写方法.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应液使酚酞试液变红色 | B. | 反应液使蓝色石蕊试纸变红色 | ||
| C. | 有大量固体析出 | D. | 反应后静置,反应液不分层 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
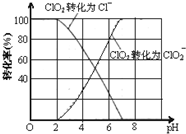 已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用.②ClO2气体在中性和碱性溶液中不能稳定存在.
已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用.②ClO2气体在中性和碱性溶液中不能稳定存在.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 放电时,电流从a极经负载后流向b极 | |
| B. | 充电时,Li+向a极移动 | |
| C. | 充电时a极发生的反应为:LiFePO4-xe-=Li1-xFePO4+xLi+ | |
| D. | 放电时,每转移xmol电子,产生1mol C6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:A2>B2>C2 | B. | 还原性:A->B->C- | ||
| C. | 单质活动性:C2>B2>A2 | D. | 反应:A2+2C-=2A-+C2不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )| A. | 催化剂a表面发生氧化反应,有O2产生 | |
| B. | 催化剂b表面的反应是CO2+2H++2e-═HCOOH | |
| C. | 催化剂a附近酸性减弱,催化剂b附近酸性增强 | |
| D. | 总的电池反应为2H2O+2CO2═2HCOOH+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com