
【题目】(1)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
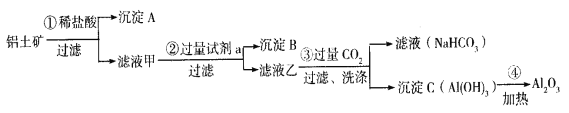
①沉淀 A、B的成分分别是____________、____________;步骤②中的试剂a是_________;(以上均填化学式)。
②试写出步骤③中发生反应的离子方式______________、________________;
③简述检验所得滤液甲中存在Fe3+的操作方法:________________________。
(2)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:

已知:在pH为4~5时,Fe3+几乎完全转化为Fe(OH)3沉淀,Cu2+却不反应。
①氧化剂最好选用__________(填编号)。
A.KMnO4 B.HNO3 C.Cl2
②写出“酸溶”时主要的离子方程式__________________________
③从滤液经过结晶得到氯化铜晶体的方法是_________(按实验先后顺序选填编号)。
A. 过滤 B. 蒸发至干 C. 冷却结晶 D. 蒸发浓缩
【答案】SiO2 Fe(OH)3 NaOH CO2 +OH- =HCO3- CO2 +AlO2- +2H2O=Al(OH)3 ↓+HCO3- 取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色,如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+ C CuO+2H+=Cu2++H2O DCA
【解析】
(1)①为盐酸,则在①得到的滤液甲中含有Al3+、Fe3+,沉淀A为二氧化硅;②为氢氧化钠溶液,除去Fe3+ ,将Al3+转化为AlO2-,在②得到的滤液乙中通入试剂③二氧化碳,将AlO2-转化为Al(OH )3沉淀,氢氧化铝加热分解得氧化铝。
(2)向固体中加入盐酸,盐酸和铁、氧化铜反应,发生的离子反应方程式为:Fe+2H+=Fe2++ H2↑;CuO+2H+=Cu2++ H2O,加入氧化剂A 的目的是把亚铁离子氧化,根据除杂原则,不能引入新的杂质;加入试剂B的目的是调节pH使铁离子生成氢氧化铁沉淀,过滤除去沉淀,对滤液进行蒸发浓缩、冷却结晶、过滤得到氯化铜晶体。
(1)①沉淀A是SiO2,沉淀B是Fe(OH )3,步骤②中的试剂a是NaOH溶液,故答案为:SiO2;Fe(OH)3;NaOH。
②滤液乙含有0H-、AlO2-,步骤③通入过量二氧化碳,与0H-反应生成碳酸氢根离子,与AlO2-反应生成的沉淀为氢氧化铝,离子方程式为: CO2 +OH- =HCO3-;CO2 +AlO2- +2H2O=Al(OH)3 ↓+HCO3-,故答案为:CO2 +OH- =HCO3-;CO2 +AlO2- +2H2O=Al(OH)3 ↓+HCO3-。
③通常用KSCN溶液检验Fe3+是否存在,取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色,如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+,故答案为:取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色,如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+。
(2)①根据题意,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以A为Cl2,故选C。
②向固体中加入盐酸,盐酸和铁、氧化铜反应,发生的离子反应方程式为:Fe+2H+=Fe2++ H2↑;CuO+2H+=Cu2++ H2O,所以“酸溶”时主要的离子方程式:CuO+2H+=Cu2++ H2O,故答案为:CuO+2H+=Cu2++ H2O。
③从滤液经过结晶得到氯化铜晶体,首先要加热蒸发浓缩,冷却结晶后,再将之过滤即可,故答案为:DCA。


科目:高中化学 来源: 题型:
【题目】人体血液存在![]() 、
、![]() 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lgx[x表示
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lgx[x表示![]() 或
或![]() ]与
]与![]() 的关系如图所示。已知碳酸
的关系如图所示。已知碳酸![]() 、磷酸
、磷酸![]() 。则下列说法正确的是
。则下列说法正确的是

A.曲线![]() 表示lg(
表示lg(![]() )与
)与![]() 的变化关系
的变化关系
B.![]() 的过程中,水的电离程度逐渐减小
的过程中,水的电离程度逐渐减小
C.当![]() 时
时![]()
D.当![]() 增大时,
增大时,![]() 逐渐减小
逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石油裂化和裂解过程得到的乙烯、丙烯来合成丙烯酸乙酯的路线如下:
 (CH2=CHCOOCH2CH3)
(CH2=CHCOOCH2CH3)
根据以上材料和你所学的化学知识回答下列问题:
(1)由CH2=CH2制得有机物A的化学方程式为______________________________________,反应类型是_____________________。
(2)检验丙烯(CH3CH=CH2)中含有的碳碳双键的化学试剂是____________________。
(3)A与B合成丙烯酸乙酯的化学方程式是______________________________________。该反应的类型是________。
(4)由石油裂解产物乙烯合成聚乙烯塑料的化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿斯巴甜(结构简式如图)具有清爽的甜味,甜度约为蔗糖的200倍。下列有关说法不正确的是

A. 分子式为:C14H18N2O5
B. 阿斯巴甜分子中有3种官能团
C. 阿斯巴甜在一定条件下既能与酸反应、又能与碱反应
D. 阿斯巴甜的水解产物中有两种氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)亚磷酸(H3PO3)为二元弱酸。 H3PO3中P元素的化合价为______,其在元素周期表的位置是__________,H3PO3与过量NaOH溶液反应的离子方程式为___________________。
(2)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图所示,化合物X可借助傅里叶红外光谱图确定。


①在图示的转化中,被还原的元素是_______________,X的化学式为________________。
②SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的量之比为2:1时,写出发生反应的化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1mol氨基甲酸铵(![]() )置于密闭容器中(容器体积不变,固体试样体积忽略不计)。在一定温度下使其分解达到平衡:
)置于密闭容器中(容器体积不变,固体试样体积忽略不计)。在一定温度下使其分解达到平衡:![]() ,下列能说明该化学反应达到平衡状态的是
,下列能说明该化学反应达到平衡状态的是
A.正、逆反应速率都为零
B.体系压强保持不变
C.![]()
D.![]() 的体积分数保持不变
的体积分数保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是A、B两种重要的有机合成原料的结构。下列有关说法中正确的是
A. ![]() B.
B.![]()
A.A与B互为同系物
B.A与B都能与溴的四氯化碳溶液发生加成反应
C.在一定条件下,A与B均能发生取代反应
D.1mol B能与4mol![]() 发生加成反应
发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)![]() C(g)+D(g)已达到平衡状态
C(g)+D(g)已达到平衡状态
①混合气体的压强 ②混合气体的密度 ③ B的物质的量浓度 ④ 混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧ B. ①③④⑤ C. ①②③④⑤⑦ D. ①③④⑤⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的数值为NA,下列说法正确的是
A.4.8gMg在足量的CO2中完全燃烧,转移电子数目为![]()
B.![]() 葡萄糖
葡萄糖![]() 含羟基
含羟基![]() 数目为
数目为![]()
C.常温常压下,![]() 和
和![]() 的混合气体含原子总数为
的混合气体含原子总数为![]()
D.10.0g质量分数为46%的酒精与足量的钠反应产生氢分子数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com