
 ,
,
 的同分异构体:
的同分异构体: 、
、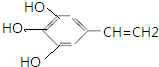 .
. 分析 (1)有机物A的分子式为C9H10O2,不饱和度为$\frac{2×9+2-10}{2}$=5,含有羧基、酚羟基两种官能团,则分子中含有1个羧基、1个羟基和1个苯环,再结合等效氢有4种来书写同分异构体;
(2)有机物 的分子式为C8H8O3,不饱和度为$\frac{2×9+2-10}{2}$=5,含有酚羟基,且能发生加聚反应,则分子中含有3个羟基,1个碳碳双键,再结合等效氢有5种来书写同分异构体.
的分子式为C8H8O3,不饱和度为$\frac{2×9+2-10}{2}$=5,含有酚羟基,且能发生加聚反应,则分子中含有3个羟基,1个碳碳双键,再结合等效氢有5种来书写同分异构体.
解答 解:(1)有机物A的分子式为C9H10O2,不饱和度为$\frac{2×9+2-10}{2}$=5,含有羧基、酚羟基两种官能团,则分子含有1个羧基、1个羟基和1个苯环,含有有4种氢原子的结构为: 、
、 ;
;
故答案为: ;
; ;
;
(2)有机物 的分子式为C8H8O3,不饱和度为$\frac{2×9+2-10}{2}$=5,含有酚羟基,且能发生加聚反应,则分子中含有3个羟基,1个碳碳双键,含有有5种氢原子的结构为:
的分子式为C8H8O3,不饱和度为$\frac{2×9+2-10}{2}$=5,含有酚羟基,且能发生加聚反应,则分子中含有3个羟基,1个碳碳双键,含有有5种氢原子的结构为: ,
, ;
;
故答案为: ;
; .
.
点评 本题考查同分异构体的书写,题目难度不大,判断官能团和支链是解题的关键.


科目:高中化学 来源: 题型:解答题
 利用如图所示的装置和其他必要的用品,利用反应:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O证明氨气具有还原性,请回答下列有关问题.
利用如图所示的装置和其他必要的用品,利用反应:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O证明氨气具有还原性,请回答下列有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHA:c(Na+)>c(HA-)>c(H+)>c(OH-) | B. | NaHA:c(Na+)=c(A2-)+c(HA-)+c(H2A) | ||
| C. | Na2A:c(Na+)>c(A2-)>c(OH-)>c(H+) | D. | H2A:c(H+)=c(HA-)+2 c(A2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ②
② ③
③ ④
④
 +4Br2→
+4Br2→ +3HBr.
+3HBr. $\stackrel{试剂1}{→}$
$\stackrel{试剂1}{→}$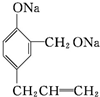 $\stackrel{试剂2}{→}$
$\stackrel{试剂2}{→}$ ,则试剂1为Na,试剂2为稀硫酸(或其他合理答案).
,则试剂1为Na,试剂2为稀硫酸(或其他合理答案).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 23gNa变为Na+时失去的电子数为NA | |
| B. | 18g水所含的电子数为NA | |
| C. | 8g He所含的分子数为NA | |
| D. | 16g O2与16g O3所含的原子数均是NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com