

试完成下列问题:
(1)该反应是氧化还原反应吗?___________,如果是氧化还原反应,请指出___________是氧化剂,___________是还原剂,写出该反应的离子方程式______________________________。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大),其作用是______________________________________________。
(3)氯气溶于水显酸性,且氯气有毒,并有强烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用____________________溶液来吸收有毒的氯气。
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:




| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
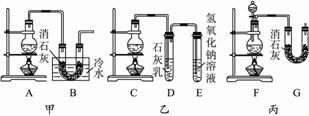
实验室中用浓盐酸与MnO2制Cl2,再用Cl2和Ca(OH)2制少量漂白粉。已知Cl2和Ca(OH)2反应制漂白粉的反应是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2![]() Ca(ClO3)2+5CaCl2+6H2O。现有甲、乙、丙三位同学设计的三套装置如下图所示(U形管中放有玻璃纤维,可使气体顺利通过)。请分析三套装置是否合理?你是如何设计的?
Ca(ClO3)2+5CaCl2+6H2O。现有甲、乙、丙三位同学设计的三套装置如下图所示(U形管中放有玻璃纤维,可使气体顺利通过)。请分析三套装置是否合理?你是如何设计的?

查看答案和解析>>
科目:高中化学 来源:2014届河南省原名校联盟高三上学期第一次摸底考试化学试卷(解析版) 题型:实验题
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
①写出该反应的离子方程式_________________________;
②下列收集Cl2的装置正确装置是_________________________;

③将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是________________________;
④设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,____________
_______________________________________________________________________________________。
(2)某化学兴趣小组为了探究AgNO3的热稳定性,设计了如下实验。
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。

①装置B的作用是___________________________。
②经小组讨论并验证该无色气体为O2,其验证方法是_____________________。
【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:i Ag;ii Ag2O;iii Ag和Ag2O
|
实验编号 |
操作 |
现象 |
|
a |
加入足量氨水,振荡 |
黑色固体不溶解 |
|
b |
加入足量稀硝酸,振荡 |
黑色固体溶解,并有气体产生 |
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验。
【实验评价】根据上述实验,不能确定固体产物成分的实验是___________(填实验编号)。
【实验结论】根据上述实验结果,该小组得出的AgNO3固体热分解的化学方程式为④______________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省汕头市高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
现有一瓶实验室放置已久的可能被氧化的Na2SO3固体,为了研究它的组成,请你参与同学们进行的如下探究活动:
可选用试剂:浓H2SO4、浓HNO3、10%盐酸、0.1mol/LH2SO4、0.1mol/LHNO3、0.1mol/LBaCl2、0.1mol/LBa(NO3)2、3%H2O2、10%NaOH溶液、蒸馏水、品红溶液;仪器自选。
(1)提出假设
假设一:固体全部是Na2SO3; 假设二:固体全部是Na2SO4;
假设三: 。
(2)设计实验方案(略);选用下图装置进行实验,该装置的优点是 。

(3)进行实验:请在下表中用简要文字写出实验操作、预期现象和结论。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取适量固体样品于微型试管中;在W管a处滴入 、b处滴入 ;用胶管将W管与微型试管连接好 |
|
|
步骤2:用针筒吸入 ,将针头穿过微型试管的胶塞,向固体样品中注入该溶液。 |
。 |
|
步骤3:拨出针筒,吸入蒸馏水洗净;再吸入 注入微型试管中 |
。 |
(4)若将上述探究过程中生成的气体通入到足量的新制漂白粉浓溶液中,则可生成白色沉淀。试写出该反应的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com