
【题目】MnO2是常见的氧化剂、催化剂和活性电极材料。
(1)工业上,以惰性材料为电极,电解MnSO4溶液(含少量稀硫酸)制备MnO2。写出阳极的电极反应式:___________。
(2)已知如下热化学方程式(K代表平衡常数):
①MnCO3(s)![]() MnO(s)+CO2(g) △H1 K1
MnO(s)+CO2(g) △H1 K1
②2MnO(s)+O2(g)![]() 2MnO2(s) △H2 K2
2MnO2(s) △H2 K2
③2MnCO3(s)+O2(g)![]() 2MnO2(s)+2CO2(g) △H3 K3
2MnO2(s)+2CO2(g) △H3 K3
△H3=______(用△H1、△H2表示) K3=_______(用K1、K2表示)。
(3)反应②在低温条件下能自发进行,则△H2______0(填“>”“<”或“=”)。
(4)在密闭容器中投入足量的MnCO3,—定条件下发生反应:MnCO3(s)![]() MnO(s)+CO2(g)
MnO(s)+CO2(g)
△H>0。在一定温度下,达到平衡状态时p(CO2)=2a MPa。

① 温度、压强对MnCO3分解率的影响如图所示:比较:L1____L2(填“>”“<”或“=”)。
② 保持温度不变,将容器体积扩大至原来的2倍,则p(CO2)的变化范围是______。
③ 保持温度不变,将容器体积压缩至原来的一半,达到新平衡时下列物理量-定不变的是__(填代号)。
A.平衡常数K B.c(CO2) C.n(CO2) D.m(MnCO3)
(5)—定温度下,在容积为2L的恒容密闭容器中加人足量的MnCO3(s)和5molO2,发生反应:2MnCO(s)+O2(g)![]() 2MnO2(s)+2CO2(g),CO2以平均速率0.1mol L-1·min-1经过10min达到平衡状态。该条件下该反应的平衡常数K为_______。
2MnO2(s)+2CO2(g),CO2以平均速率0.1mol L-1·min-1经过10min达到平衡状态。该条件下该反应的平衡常数K为_______。
【答案】 ⑴ Mn2++2H2O-2e-=MnO2+4H+ ⑵ 2△H1+△H2 ![]() ·K2 ⑶ < ⑷① >
·K2 ⑶ < ⑷① >
②a MPa<p(CO2)<2a MPa ③AB ⑸ 0.5mol.L-1
【解析】(1)根据电解原理,用惰性电极电解MnSO4溶液制得MnO2的阳极为:Mn2+失电子发生氧化反应生成MnO2,其阳极电极反应式是Mn2++2H2O2e-=MnO2+4H+。
(2)由已知三个化学方程式可得:③=①×2+②,所以△H1=2△H1+△H2 、K3= K12K2 。
(3)反应②在低温条件下能自发进行,所以△H2T△S<0,根据化学方程式可看出△S<0,所以△H2<0。
(4)①根据上述MnCO3分解的化学方程式及△H>0可得:增大压强压缩体积,MnCO3分解率降低,升高温度MnCO3分解率增大,所以图中X代表压强,L1和L2代表温度,L1>L2;②保持温度不变,将容器体积扩大至原来的2倍,若平衡不移动,则p(CO2)= a MPa,而实际情况是:降低压强平衡右移,所以p(CO2)> MPa,又根据化学平衡移动原理(即勒夏特列原理)p(CO2)< 2a MPa,综上所述,a MPa <p(CO2)< 2a MPa;③ 保持温度不变,化学平衡常数不变,将容器体积压缩至原来的一半,化学平衡逆向移动,n(CO2)减小, m(MnCO3)增大,因为只有一种气体,所以c(CO2)不变。故选AB。
(5)由题意该反应达到平衡状态时c(CO2)=0.1mol L-1 min-1×10min=1 mol L-1,列三段式得:

所以K=![]() =(1 mol·L-1)2 ÷ 2 mol·L-1=0.5mol.L-1
=(1 mol·L-1)2 ÷ 2 mol·L-1=0.5mol.L-1


科目:高中化学 来源: 题型:
【题目】下列物质中所含的杂质(括号中是杂质),使用NaOH溶液不能除去的是
A.MgO固体(Al2O3) B.Na2CO3固体(NaHCO3)
C.FeCl2溶液(CuCl2) D.Fe2O3固体(SiO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g) 达到平衡。下列说法正确的是
CH3OH(g) 达到平衡。下列说法正确的是

A.该反应的正反应放热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烷烃CH3CH2CH(CH2CH2CH3)CH(CH3)CH3的命名正确的是
A. 4—甲基—3—丙基戊烷 B. 3—异丙基己烷
C. 2—甲基—3—丙基戊烷 D. 2—甲基—3—乙基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用5 mol/L 的HNO3溶液配制500 mL 1 mol/L的HNO3溶液时,不需用到的仪器是
A. 分液漏斗B. 胶头滴管C. 烧杯D. 500 mL容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 钠与水反应: Na +2H2O![]() Na++2OH– + H2↑
Na++2OH– + H2↑
B. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+
C. 向氢氧化钡溶液中加入稀硫酸: Ba2++OH– + H+ + ![]()
![]() BaSO4↓+H2O
BaSO4↓+H2O
D. 向碳酸氢铵溶液中加入足量石灰水: Ca2++![]() +OH–
+OH–![]() CaCO3↓+H2O
CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H—H | C—O | C | H—O | C—H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1= kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3= kJ·mol-1。
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
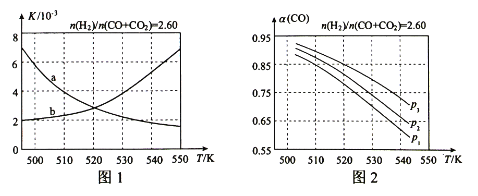
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。图2中的压强由大到小为_____,其判断理由是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com