
| A. | ①不变浑浊,②变浑浊 | B. | ①变浑浊,②不变浑浊 | ||
| C. | ①变浑浊,②变浑浊 | D. | ①不变浑浊,②变浅黄色 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

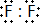 ,两者气态氢化物的稳定性是:HF>HCl(填写化学式).
,两者气态氢化物的稳定性是:HF>HCl(填写化学式).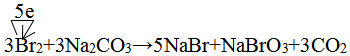 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓硝酸与浓盐酸一样,在空气中出现白雾 | |
| B. | 硝酸见光分解和受热分解产物相同,都是NO2、O2、H2O | |
| C. | NO2和水反应有HNO3生成,所以NO2是硝酐 | |
| D. | 硝酸与金属反应,既表现出氧化性,又表现出酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
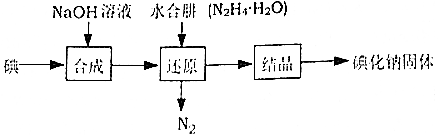
| 规定序号 | 待测体积/mL | 盛装标准滴定管的起点读数/mL | 盛装标准滴定管的终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g乙醛与乙酸乙酯的混合物中含氧原子数为NA | |
| B. | 40gH2${\;}_{\;}^{18}$O与40gD2O所含的中子数均为20NA | |
| C. | 1molFe分别与足量的稀硫酸和稀硝酸反应转移电子数均为2NA | |
| D. | 62gNa2O与78gNa2O2所含的阴离子数均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 结论 |
| A | 配制Fe(NO3)2溶液时加入适量的硝酸 | 抑制Fe2+水解 |
| B | 浓硫酸和蔗糖反应产生的气体通过足量的KMnO4溶液,气体全部被吸收且溶液紫红色褪去 | “黑面包实验”产生的气体具有还原性 |
| C | 往溶液中滴加NaOH溶液,将湿润红色石蕊试纸置于试管口试纸不变蓝 | 原溶液中无NH4+ |
| D | 幼儿使用含NaF的牙膏,可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F,防止蛀牙 | Ksp[Ca5(PO4)3F]<Ksp[Ca5(PO4)3OH] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com