
【题目】一份溶液中可能大量含有K+、A13+、H+、NH4+、Cl-、Br-、I-、ClO-、A1O2-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积关系如图所示:
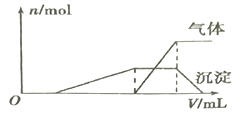
则该溶液中一定存在的离子是________,一定不大量存在的离子是__________。
(2)经检测后,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的氯气,则溶液中Cl-、Br-、I-、与通入氯气的体积(标准状况下)关系如下表所示,回答下列问题:
Cl2的体积(标准状况下) | 2.8 L | 5.6 L | 11.2 L |
n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
n(I-) | a mol | 0 | 0 |
当通入的氯气为2.8L(标准状况下)时,溶液中发生反应的离子方程式为___________,原溶液中n(Cl-)为____mol;通入氯气的体积在2.8L~5.6L(标准状况下)之间时的有关离子方程式为(如有多个反应,请分开书写)_________________,原溶液中Cl-、Br-、I-的物质的量浓度之比为_______________。
【答案】 Al3+、H+、NH4+ ClO-、AlO2- Cl2+2I-=2Cl-+I2 1 Cl2+2I-=2Cl-+I2、Cl2+2Br-=2Cl-+Br2 10:15:4
【解析】(1)加入NaOH,开始无气体和沉淀,则原溶液中含有H+,从而不含ClO-和AlO2-;再加入NaOH,开始产生沉淀,则原溶液中含有Al3+,当沉淀的量达到最大值时,沉淀的量不变,而开始产生气体,则原溶液中含有NH4+,当NH4+反应完后,再加NaOH溶液,沉淀溶解。据此判断:该溶液中一定存在的离子是:Al3+、H+、NH4+,一定不大量存在的离子是:ClO-、AlO2-,可能存在的离子是:K+、Cl-、Br-、I-。
(2)在含有 Cl-、Br-、I-的混合溶液中,由于还原性大小顺序为:I->Br-,通入Cl2时,Cl2先与I-反应,再与Br-反应。2.8L Cl2的物质的量为0.125mol,当第一次通入0.125molCl2时,仍有a mol I-剩余,此阶段Br-未参与反应,故原溶液中Br-的物质的量为1.5mol,所以第一次通入Cl2的过程中只发生Cl2与I-的反应。离子方程式为:Cl2+2I-=2Cl-+I2,消耗的I-的物质的量为2×0.125mol=0.25mol,则原溶液中的Cl-的物质的量为1.25 mol-0.125mol×2=1mol;通入氯气的体积在2.8L~5.6L(标准状况下)之间时(即0.125mol),未反应的a molI-先完全反应,然后Br-反应掉0.1mol,此过程中发生了两个反应:Cl2+2I-=2Cl-+I2、Cl2+2Br-=2Cl-+Br2;消耗掉0.1molBr-需要消耗0.05molCl2,所以a molI-消耗的Cl2的物质的量为0.125mol-0.05mol=0.075mol,故a=0.075mol×2=0.15mol,加上第一次消耗掉的0.25molI-,故原溶液中总共含有I-的物质的量为0.15mol+0.25mol=0.4mol。综上所述:原溶液中Cl-、Br-、I-的物质的量的比为:1:1.5:0.4=10:15:4,所以浓度比为10:15:4。


科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分A12O3另含少量的SiO2、Fe2O3等)是工业上制铝的原料。实验室模拟工业上以铝土矿为原料制取铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如下图所示:

请回答下列问题:
(1)为提高铝土矿与盐酸的反应速率,可采取的措施有______________________________(写两条)。
(2)固体a的主要成分为__________________(写化学式)。
(3)II中烧碱过量的原因是________________________________________。
(4)写出III中主要反应的离子方程式__________________________________________。
(5)制取铵明矾溶液的化学方程式为_________________________________________;由铵明矾溶液制取铵明矾晶体的实验操作依次为(填操作名称)______________________、____________、过滤、洗涤。
(6)设计实验证明铵明矾溶液中含有NH4+_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①乙炔 ②苯酚溶液 ③乙醛 ④淀粉溶液 ⑤氨基酸.请回答:
(1)遇碘水呈蓝色的是(填序号,下同).
(2)能发生成肽反应的是 .
(3)能跟溴发生加成反应的是 .
(4)能跟银氨溶液发生银镜反应的是 .
(5)能跟饱和溴水反应生成白色沉淀的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.石油裂解主要是为了获得气态不饱和短链烃
B.煤是由有机物和无机物组成的复杂的混合物,其中含有焦炭、苯、甲苯等
C.甲醛俗称蚁醛,可用于制造酚醛树脂
D.生产口罩的熔喷布主要成分是聚丙烯,可通过丙烯加聚得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法不正确的是( )
A.氯乙烯分子中所有原子共平面B.乙醇、乙酸都能发生取代反应
C.乙酸乙酯、甲酸丙酯的密度都小于水D.淀粉和纤维素互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是一种常用香料2的主要成分之一,由烃A合成其路线如下。
己知:①B的结构简式为:![]()
②RC≡CH+HCHO![]() RC≡CCH2OH;
RC≡CCH2OH;
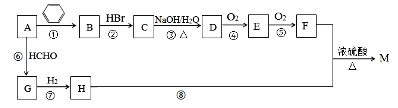
回答下列问题:
(1)A的系统命名为_________。
(2)反应⑥反应类型是____________;F中官能团的名称_______________。
(3)物质M的结构简式为_____________________。
(4)反应③的化学反应方程式为_______________________。
(5)符合下列条件的F的同分异构体共有____种。
①能发生银镜反应;②能发生水解反应;③属于芳香族化合物;④苯环上有两个氢原子被取代。(6)已知:①当苯环上已有—个“一 CH3”时,新引入的取代基一般在原有取代基的邻位或对位上。②酸性高锰酸钾溶液可以把苯环上的“一CH3”氧化成“—COOH”。请用合成反应流程图表示出由甲苯和其他物质合成![]() 的最佳方案,合成反应流程表示方法示例如下:
的最佳方案,合成反应流程表示方法示例如下: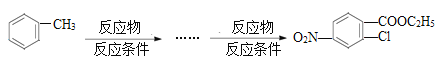 ________________。
________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者小于后者的是
①C(s)+ ![]() O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
②S(g)+O2(g) ===SO2(g);ΔH3 S(s)+O2(g) ===SO2(g);ΔH4
③CaO(s)+H2O(l) ===Ca(OH)2(s);ΔH5 CaCO3(s) ===CaO(s)+CO2(g);ΔH6
A.② B.①② C.①③ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
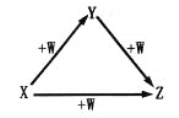
①C、CO ②AlCl3、 Al(OH)3 ③N2、NO ④S、SO2
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2HCHO2H2O)俗称吊白块,不稳定,120℃时会分解。在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
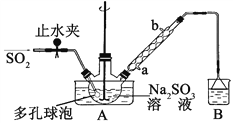
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。
步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B 的烧杯中应加入的溶液是____________;冷凝管中冷却水从_____(填“a”或“b”)口进水。
(2)A中多孔球泡的作用是__________________________________________。
(3)冷凝管中回流的主要物质除H2O 外还有________ (填化学式)。
(4)写出步骤2中发生反应的化学方程式________________________________。
(5)步骤3中在真空容器中蒸发浓缩的原因是____________________________。
(6)为了测定产品的纯度,准确称取2.0g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,则所制得的产品的纯度为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com