
 下图是盐酸与氢氧化钠溶液的滴定曲线a和b.
下图是盐酸与氢氧化钠溶液的滴定曲线a和b.分析 (1)根据曲线a的pH的变化趋势来判断;
(2)根据曲线P点时pH值为7,此时氢离子和氢氧根离子的物质的量是相等的;
(3)根据曲线a可以看出盐酸溶液的pH=1,然后求出盐酸的物质的量浓度;
解答 解:(1)曲线a的pH是由小到大,说明是氢氧化钠溶液滴定盐酸溶液的曲线,曲线b的pH是由大到小,说明是盐酸溶液滴定氢氧化钠溶液的曲线,
故答案为:NaOH;HCl;HCl;NaOH;
(2)根据图示,可以知道盐酸的浓度和氢氧化钠的浓度是相等的,都是0.1mol/L,曲线P点时pH值为7,此时氢离子和氢氧根离子的物质的量是相等的,氢氧化钠的体积是15,所以盐酸的体积也是15mL,即P的坐标是(15,7),
故答案为:P(15,7);
(3)根据曲线的起点可以看出盐酸溶液的pH=1,pH=-lgc(H+)=1,所以c(HCl)=c(H+)=0.1mol/L,根据曲线的起点可以看出氢氧化钠溶液的pH=13,所以氢氧化钠的浓度为0.1mol/L,所以根据坐标可知,氢氧化钠的体积为15mL时,酸碱恰好完全反应,
故答案为:0.1;15.
点评 本题借助于滴定曲线考查了中和滴定过程中PH的变化,难度不大,关键能从图中要得出信息.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
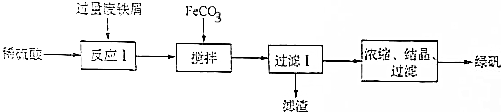

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
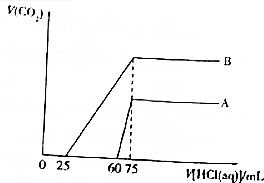 取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如图所示.
取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生的反应都是置换反应 | B. | 实验所得滤液是纯水,可直接排放 | ||
| C. | 滤渣中一定含铜和锌 | D. | 反应前后液体的酸性减弱,pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 29:13:8 | B. | 13:29:8 | C. | 22:14:1 | D. | 26:57:15 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com