
【题目】常温下,某化学小组探究硝酸银溶液的性质。
装置 | 实验序号 | 实验操作 | 实验现象 |
| 实验I | 向试管中滴加2%氨水并不断振荡 | 产生棕褐色沉淀,继续滴加沉淀消失 |
实验II | 1.向试管中加入0.1mol·L-lNaOH溶液1mL 2.继续滴加3%H2O2至过量 | 1.产生棕褐色沉淀 2.产生大量无色无味气体,有黑色沉淀生成 | |
实验III | 1.向试管中滴加1mL0.1molL-1KI溶液 2.取少量上层清液于试管甲中,加入淀粉溶液 | 1.产生黄色沉淀 2.溶液无明显变化 |
已知:AgOH是一种白色固体,常温下极不稳定,易分解为棕褐色难溶于水的氧化银固体
(1)常温下,0.1mo1L-1AgNO3溶液pH约为4,请用离子方程式解释原因___。
(2)实验I中,反应的化学方程式是___。
(3)实验II中,经检验,黑色沉淀的成分为Ag。有Ag产生的化学方程式是___。经测定,实验产生的气体体积远远大于该反应的理论值,可能的原因是___。
(4)实验中,产生黄色沉淀的离子方程式是___。有同学猜想,I-有还原性,Ag+有氧化性,AgNO3溶液与KI溶液应该可以发生氧化还原反应。他设计了如图原电池,做实验IV证明了猜想成立。其中,在A烧杯中,石墨电极表面变亮,经检测这种光亮的物质为银单质。乙溶液是___,检验B烧杯中产物的操作及现象是___,该氧化还原反应的离子方程式是__。

(5)对比实验III和实验IV,实验III无I2生成的可能原因是___(写出两条)。
【答案】Ag++H2O![]() AgOH+H+ AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O Ag2O+H2O2=2Ag+O2+H2O Ag2O有催化作用,可以催化H2O2的分解,导致气体体积增大 Ag++I-=AgI↓ 0.1molL-1KI溶液 取少量反应后B烧杯中溶液,滴加淀粉溶液,有蓝色出现 2Ag++2I-=2Ag↓+I2 Ag+与I-发生氧化还原反应的速率慢于发生沉淀反应的速率;物质的氧化性还原性受浓度影响,溶液中离子浓度较小时,氧化还原反应不易发生
AgOH+H+ AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O Ag2O+H2O2=2Ag+O2+H2O Ag2O有催化作用,可以催化H2O2的分解,导致气体体积增大 Ag++I-=AgI↓ 0.1molL-1KI溶液 取少量反应后B烧杯中溶液,滴加淀粉溶液,有蓝色出现 2Ag++2I-=2Ag↓+I2 Ag+与I-发生氧化还原反应的速率慢于发生沉淀反应的速率;物质的氧化性还原性受浓度影响,溶液中离子浓度较小时,氧化还原反应不易发生
【解析】
(1)AgNO3为强酸弱碱盐,Ag+水解,溶液呈酸性;
(2)AgNO3溶液中滴加氨水,发生复分解反应,产生AgOH的白色沉淀,AgOH极不稳定,易分解为棕褐色难溶于水的Ag2O固体,继续滴加氨水,AgOH与氨水反应生成银氨溶液,沉淀消失,据此写出化学方程式;
(3)AgNO3溶液中加入NaOH溶液,发生复分解反应,产生AgOH的白色沉淀,AgOH极不稳定,易分解为棕褐色难溶于水的Ag2O固体,继续滴加H2O2至过量,AgO 被H2O2还原生成Ag单质;Ag2O有催化作用,催化H2O2分解生成O2,导致气体体积增大;
(4)AgNO3溶液中滴加KI溶液,发生复分解反应,产生AgI的黄色沉淀;在A烧杯中,石墨电极表面变亮,经检测这种光亮的物质为银单质,甲溶液为0.1molL-1AgNO3溶液,乙溶液是0.1molL-1KI溶液;用淀粉溶液,检验I2;根据得失电子守恒写出离子方程式;
(5)实验III中,Ag+与I-发生氧化还原反应的速率慢于发生沉淀反应的速率;物质的氧化性与还原性受浓度影响,溶液中离子浓度较小时,氧化还原反应不易发生;
(1)AgNO3为强酸弱碱盐,Ag+水解,溶液呈酸性,Ag++H2O![]() AgOH+H+,故答案为:Ag++H2O
AgOH+H+,故答案为:Ag++H2O![]() AgOH+H+;
AgOH+H+;
(2)AgNO3溶液中加氨水,发生复分解反应,产生AgOH的白色沉淀,AgNO3+NH3·H2O=AgOH↓+NH4NO3,AgOH极不稳定,易分解为棕褐色难溶于水的Ag2O固体,2AgOH=AgO+HO,继续加氨水,AgOH与氨水反应生成银氨溶液,沉淀消失,AgOH+2NH3·H2O=[Ag(NH3)2]OH+2H2O,则实验I中,发生的反应的化学方程式为:AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O,故答案为:
AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O;
(3)AgNO3溶液中加入NaOH溶液,发生复分解反应,产生AgOH的白色沉淀,AgNO3+NaOH=AgOH↓+NaNO3,AgOH极不稳定,易分解为棕褐色难溶于水的Ag2O固体,2AgOH=AgO+HO,继续滴加H2O2至过量,AgO 被H2O2还原生成Ag单质,其化学反应方程式为:Ag2O+H2O2=2Ag+O2+H2O;Ag2O具有催化作用,可以催化H2O2分解生成H2O和O2,导致气体体积增大,故答案为:Ag2O+H2O2=2Ag+O2+H2O;Ag2O有催化作用,可以催化H2O2的分解,导致气体体积增大;
(4)AgNO3溶液中滴加KI溶液,发生复分解反应,产生AgI的黄色沉淀,其离子反应方程式为:Ag++I-=AgI↓;在A烧杯中,石墨电极表面变亮,经检测这种光亮的物质为银单质,则A烧杯中发生的反应为:Ag++e-=Ag↓,甲溶液为0.1molL-1AgNO3溶液,则B烧杯中发生的反应为:2I--2e-=I2,乙溶液是0.1molL-1KI溶液;检验B烧杯中产物:取少量反应后B烧杯中溶液于试管中,滴加淀粉溶液,若有蓝色出现,则证明产物为I2;该氧化还原反应的离子方程式为:2Ag/span>++2I-=2Ag↓+I2,故答案为:Ag++I-=AgI↓;0.1molL-1KI溶液;取少量反应后B烧杯中溶液,滴加淀粉溶液,有蓝色出现;2Ag++2I-=2Ag↓+I2;
(5)对比实验III和实验IV,实验III中,Ag+与I-发生氧化还原反应的速率慢于发生沉淀反应的速率;物质的氧化性与还原性受浓度影响,溶液中离子浓度较小时,氧化还原反应不易发生,故答案为:Ag+与I-发生氧化还原反应的速率慢于发生沉淀反应的速率;物质的氧化性与还原性受浓度影响,溶液中离子浓度较小时,氧化还原反应不易发生。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】物质分离、提纯的常用装置如图所示,根据题意选择合适的装置填入相应位置。

(1)我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写到:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”所用的是__装置(填“甲”、“乙”、“丙”、“丁”或“戊”,下同)。
(2)《本草衍义》中对精制砒霜过程的叙述为:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下重如乳,尖长者为胜,平短者次之。”文中涉及的操作方法所用是_____装置。
(3)海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
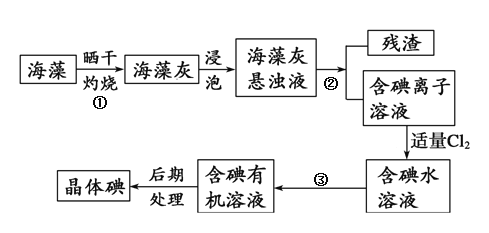
其中分离步骤①、②、③所用分别为:_____装置、_____装置、_____装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某不饱和烃与氢气加成后的生成物为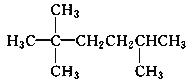 ,请按要求回答下列问题:
,请按要求回答下列问题:
(1)请用系统命名法对该物质进行命名:________________。
(2)若该不饱和烃为一单烯烃,则可能有________种结构,结构简式分别为______________(有几种写几种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验。
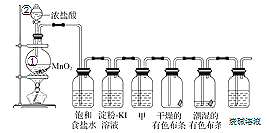
请按要求回答下列问题:
(1)仪器②的名称___________,①中反应的离子方程式__________
(2)浓盐酸的作用_______、______________,饱和食盐水的作用__________
(3)淀粉KI溶液中观察到的现象是______________,反应的离子方程式为________。
(4)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放的是________(填名称)。
(5)Cl2与烧碱溶液反应制取84消毒液的化学方程式为________。
(6)该兴趣小组用0.2mol 二氧化锰与足量的浓盐酸制备氯气,则理论上最多可制得氯气的质量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年初,突如其来的新型冠状肺炎在全世界肆虐,依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(C1O2)就是其中一种高效消毒灭菌剂。但其稳定性较差,可转化为NaC1O2保存。分别利用吸收法和电解法两种方法得到较稳定的NaClO2。其工艺流程示意图如图所示:

已知:1.纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
2.长期放置或高于60℃时NaC1O2易分解生成NaC1O3和NaCl
(1)步骤1中,生成C1O2的离子方程式是___,通人空气的作用是___。
(2)方法1中,反应的离子方程式是___,利用方法1制NaC1O2时,温度不能超过20℃,可能的原因是___。
(3)方法2中,NaC1O2在___生成(选填“阴极”或“阳极”)。
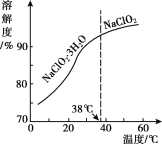
(4)NaC1O2的溶解度曲线如图所示,步骤3中从NaC1O2溶溶液中获得NaC1O2的操作是___。
(5)为测定制得的晶体中NaC1O2的含量,做如下操作:
①称取a克样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用bmolL-1Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为cmL(已知:I2+2S2O32-=2I-+S4O62-)。样品中NaC1O2的质量分数为___。(用含a、b、c的代数式表小)。在滴定操作正确无误的情况下,测得结果偏高,可能的原因是___(用离子方程式和文字表示)。
(6)NaC1O2使用时,加入稀盐酸即可迅速得到C1O2。但若加入盐酸浓度过大,则气体产物中Cl2的含量会增大,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮及其化合物,说法不正确的是
A.氮气是空气中含量最高的气体,性质比较稳定
B.人工固氮需要在高温高压催化剂的条件下进行,但这是个放热反应
C.工业硝酸往往会发黄,因为其中含有Fe3+
D.常温下,浓硝酸可以利用铁罐车进行运输
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物是一种皮肤药物的中间体,结构如图所示,下列说法不正确的是:
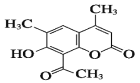
A.该有机物所有碳原子都可能同平面
B.该有机物遇FeCl3会显紫色
C.1mol该有机物最多可以与2molNaOH反应
D.1mol该有机物最多可以与5molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组需要用18mol/L 的浓硫酸配制80mL3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③稀释 ④检漏、转移、洗涤 ⑤定容、摇匀。回答下列问题:
(1)所需浓硫酸的体积是___mL,量取浓硫酸所用的量筒的规格是___(用下列编号填空)。
A.10 mL B.25mL C.50mL D.100mL
(2)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线1-2cm处,改用___向容量瓶中滴加蒸馏水至凹液面和刻度线相切为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(3)下列情况对所配制的稀硫酸浓度有何影响?(填“偏大”“偏小”或“无影响”)
①容量瓶用蒸馏水洗涤后残留有少量的水___;
②在转入容量瓶前烧杯中溶液未冷却至室温___;
③取完浓硫酸后洗涤量筒,并把洗涤液倒入烧杯___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用电解铬酐(CrO3,遇水生成H2Cr2O7和H2CrO4)水溶液的方法镀铬,电镀液中需加入适量的催化剂和添加剂,并通过加入H2O2提高或降低电镀液中Cr(Ⅲ)的含量,发生的部分反应有:
①Cr2O72-+14H++6e=2Cr3++7H2O
②2H++2e=H2
③2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
④CrO42-+8H++6e=Cr+4H2O
⑤2H2O4e=O2+4H+
⑥2Cr3++7H2O6e=Cr2O72-+14H+
下列说法错误的是( )
A.反应①②在镀件上发生
B.H2O2既体现氧化性又体现还原性
C.当镀件上析出52g单质铬时,电路中转移6mol电子
D.电镀一段时间后,电极附近溶液的pH:阳极>阴极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com