
【题目】按照如图所示的操作步骤,完成铝与盐酸反应的实验。
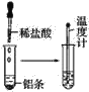
回答下列问题:
(1)实验过程中观察到的实验现象是__。
(2)写出铝与盐酸反应的离子方程式__。
(3)该反应是放热反应还是吸热反应__。
科目:高中化学 来源: 题型:
【题目】一氧化碳和氢气是重要的化工原料,常用于合成甲醇、二甲醚、甲酸甲酯等有机物。
(1)已知![]() 的燃烧热分别是
的燃烧热分别是![]() ,则甲醇与一氧化碳催化合成乙酸的热化学方程式为_____________。
,则甲醇与一氧化碳催化合成乙酸的热化学方程式为_____________。
(2)有人设想将![]() 按下列反应除去
按下列反应除去![]() ,该反应能否自发进行______________(填“是”或“否”),依据是_____________。
,该反应能否自发进行______________(填“是”或“否”),依据是_____________。
(3)向体积可变的密闭容器中投入![]() 和
和![]() ,在不同条件下发生反应:
,在不同条件下发生反应:![]() 。测得
。测得![]() 的平衡转化率随温度、压强的变化如图所示。
的平衡转化率随温度、压强的变化如图所示。
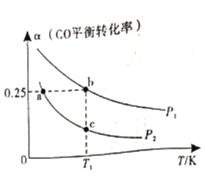
①该可逆反应的![]() __________0(填>”、“<”或“=”)。a、b、c三点对应的平衡常数
__________0(填>”、“<”或“=”)。a、b、c三点对应的平衡常数![]() 的大小关系是____________________。
的大小关系是____________________。
②在恒温恒容条件下进行该反应,能表示反应达到平衡状态的是______________(填字母)。
a. CO的体积分数保持不变
b. 容器内混合气体的密度保持不变
c.容器内混合气体的平均摩尔质量保持不变
d.单位时间内消耗CO的浓度等于生成![]() 的浓度
的浓度
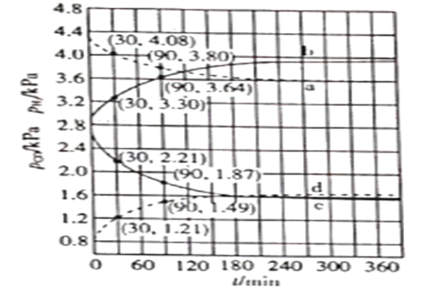
(4)在催化剂作用下,![]() 时分别进行反应:
时分别进行反应:![]() ,
,![]() ,测得CO和
,测得CO和![]() 的分压随时间的变化关系如图所示。起始时,体系中
的分压随时间的变化关系如图所示。起始时,体系中![]() 和
和![]() 相等、
相等、![]() 和
和![]() 相等。计算曲线a的反应在
相等。计算曲线a的反应在![]() 内的平均速率
内的平均速率![]() _______
_______![]() 。
。![]() 时
时![]() 随时间变化关系的曲线是_______,
随时间变化关系的曲线是_______,![]() 时
时![]() 随时间变化关系的曲线是___________。
随时间变化关系的曲线是___________。
(5)一定条件下,![]() 与粉末状氢氧化钠反应生成甲酸钠。已知:常温时,甲酸的电离平衡常数
与粉末状氢氧化钠反应生成甲酸钠。已知:常温时,甲酸的电离平衡常数![]() 。向
。向![]() 的甲酸钠溶液中加入
的甲酸钠溶液中加入![]() 的盐酸,混合液呈__________性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为__________________。
的盐酸,混合液呈__________性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述中正确的是( )
A.化学反应速率的关系是2υ逆(NH3)=3υ正(H2O)
B.恒容时,混合气体的平均密度保持不变的时候,可以证明达到平衡
C.达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D.达到化学平衡时4υ正(O2)=5υ逆(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年因生锈损失的钢铁,约占世界年产量的十分之一。一种钢铁锈蚀原理示意图如右,下列说法不正确的是

A. 缺氧区:Fe-2e-=== Fe2+
B. 富氧区:O2 + 2H2O + 4e-=== 4OH-
C. Fe失去的电子通过电解质溶液传递给O2
D. 隔绝氧气或电解质溶液均可有效防止铁生锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分为CuCO3·Cu(OH)2设计从孔雀石中冶炼铜的方案如下:

(1)将孔雀石粉碎的目的是_______,加入过量稀硫酸,可观察到的现象是_______
(2)操作a的名称是_______,在滤液中加入过量铁粉发生的反应有___________(用离子方程式表示)
(3)在悬浊液中加入A的目的是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸的下列性质中,可以证明它是弱电解质的是
A. 0.1mol/L醋酸溶液的c(H+)约为1×10-3mol/L
B. 醋酸能与水以任何比例互溶
C. 10mL 1mol/L醋酸恰好与10mL 1mol/L NaOH溶液完全反应
D. 醋酸溶液的导电性比盐酸溶液的弱
【答案】A
【解析】0.1mol/L醋酸溶液的c(H+)约为1×10-3mol/L,说明醋酸只电离了一部分,所以是弱电解质,选项A正确。醋酸能与水以任何比例互溶是醋酸的物理性质,这个与电解质的强弱无关,选项B错误。10mL 1mol/L的一元酸(无论强弱)都会恰好与10mL 1mol/L NaOH溶液完全反应,所以选项C错误。因为没有说明浓度的关系,所以醋酸溶液的导电性比盐酸溶液的弱,并不能说明醋酸是弱电解质,选项D错误。
点睛:证明一个一元酸HA是弱电解质的方法主要有:
配成0.1mol/L的溶液,测得氢离子浓度小于0.1mol/L,或者测得pH>1。
测NaA的溶液的酸碱性,得到该溶液显碱性。
配成相同浓度的HA和HCl溶液,测得HA的导电性较差。
【题型】单选题
【结束】
16
【题目】下列表示化学过程的化学用语书写正确的是
A. BaSO4投入水中后建立的沉淀溶解平衡:BaSO4![]() Ba2++SO42-
Ba2++SO42-
B. AlCl3溶液与NaAlO2溶液混合:A13++A1O2-+3H2O![]() 2Al(OH)3↓
2Al(OH)3↓
C. HCO3-的电离:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D. Na2SO3的水解:SO32-+2H2O![]() H2SO3+2OH-
H2SO3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学设计的放热反应的观察装置,
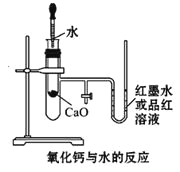
其实验操作步骤如下:
①按图所示将实验装置连接好;
②在U形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;
③在盛有1.0g氧化钙的小试管里滴入2 mL左右的蒸馏水,观察现象。
试回答:
(1)实验前必须进行的一步实验操作是_______________。
(2)实验中观察到的现象是______________________________________________________________。
(3)实验中发生的化学反应方程式:____________________________。
(4)说明CaO、H2O的能量与Ca(OH)2的能量之间的关系:_______________________________________。
(5)若该实验中CaO换成NaCl,实验还能否观察到相同现象?____(填“能”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如下图所示(电极未标出),下列说法不正确的是( )
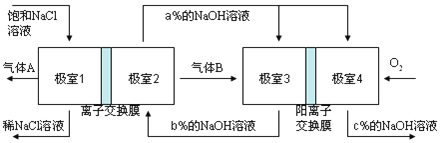
A. 气体B为H2
B. 相同条件下,当电解池生成2L Cl2,理论上燃料电池应消耗1L O2
C. 极室1 与极室2之间的离子交换膜也为阳离子交换膜
D. 溶液a、b、c的pH大小顺序为:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X 为阳离子交换膜。下列有关说法正确的是
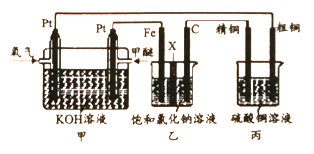
A. 反应一段时间后,乙装置中生成的氢氧化钠在铁极区
B. 乙装置中铁电极为阴极,电极反应式为Fe-2e-= Fe2+
C. 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
D. 通入氧气的一极为正极,发生的电极反应为O2 - 4e- + 2H2O = 4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com