
| A. | 温度升高,三者都增大 | |
| B. | 室温下Ka(HCN)<Ka(CH3COOH),说明CH3COOH的电离度一定比HCN大 | |
| C. | 2SO2(g)+O2(g)?2SO3(g)平衡后,仅增大压强,平衡向右移动,但K值不变 | |
| D. | 化学平衡常数的大小与温度、浓度、催化剂等有关 |
分析 A.升高温度后,化学平衡向着吸热的方向移动;
B.电离度与起始浓度、同离子效应等有关;
C.改变压强平衡发生移动,但是K不变;
D.平衡常数与温度有关,与浓度、压强、催化剂无关.
解答 解:A.升高温度,电离平衡常数、水的离子积增大,而化学平衡常数不一定增大,升高温度后,化学平衡向着吸热的方向移动,若正反应为放热反应,则化学平衡常数减小,故A错误;
B.相同温度下CH3COOH、HCN的电离度与起始浓度、同离子效应等有关,所以CH3COOH的电离度不一定比HCN大,故B错误;
C.改变压强平衡发生移动,仅增大压强,平衡向右移动,温度不变K值不变,故C正确;
D.化学平衡常数只与温度有关,温度不变化学平衡常数不变,而与浓度、压强及催化剂无关,故D错误;
故选C.
点评 本题考查了弱电解质的电离、化学平衡常数及其影响因素,题目难度不大,注意掌握电离平衡的影响因素,明确升高温度化学平衡常数不一定增大,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 试管、蒸发皿既能用于给固体加热也能用于给溶液加热 | |
| B. | 分液漏斗既能用于某些混合物的分离也能用于组装气体发生装置 | |
| C. | 碱式滴定管既可用于中和滴定,也可用于量取一定量的NaCl或AlCl3溶液 | |
| D. | 测量酒精沸点的实验中,应使温度计水银球位于被加热的酒精中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
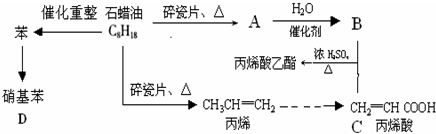
 A→B的反应类型:加成反应
A→B的反应类型:加成反应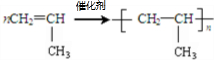 ;
;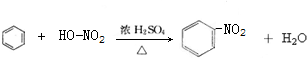 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同温度下,等浓度的H2SO4和CH3COOH溶液中的c(H+) | |
| B. | 相同温度下,等浓度的Ba(OH)2和NaOH溶液,前者与后者的c(OH-) | |
| C. | 相同温度下,0.2 mol•L-1醋酸溶液和0.1 mol•L-1醋酸溶液中的c(H+) | |
| D. | 液面在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛液体的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,溶液中c(OH-) 增大 | |
| B. | 加入少量NH4Cl固体,平衡向逆方向移动,电离平衡常数减小 | |
| C. | 通入少量HCl气体,溶液中c(NH4+)增大 | |
| D. | 降低温度,促进NH3•H2O电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
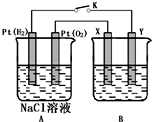 某化学兴趣小组用下图所示装置进行电化学原理的实验探究,回答下列问题:
某化学兴趣小组用下图所示装置进行电化学原理的实验探究,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.10mol/L NH4HCO3中溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) | |
| B. | 向0.10mol/L NaHSO3中溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol/L Na2SO3中溶液中通入SO2:c(Na+)=2[c(H2SO3)+c(HSO3-)+c(SO32-)] | |
| D. | 向0.10mol/L CH3COONa中溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com