
| A. | 将某浓度氢氟酸溶液升高温度,氢氟酸的电离平衡常数Ka将变小 | |
| B. | 常温下,向纯水中加入碳酸钠,水的电离程程度变大,Kw变大 | |
| C. | 化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变 | |
| D. | 已知,K=$\frac{{c}^{2}(C{O}_{2})•{c}^{6}({H}_{2})}{{c}^{3}({H}_{2}O)•c(C{H}_{3}C{H}_{2}OH)}$则对应的化学反应可以表示为:CH3CH2OH(g)+3H2O(g)?2CO2( g)+6H2(g) |
分析 A.弱电解质的电离为吸热反应;
B.温度不变,Kw不变;
C..温度变化,化学平衡常数一定变化;
D.根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积判断反应的化学方程式.
解答 解:A.氢氟酸为弱酸,电离吸热,升高温度平衡向正反应方向移动,则电离平衡常数Ka变大,故A错误;
B.Kw只受温度的影响,温度不变,Kw不变,故B错误;
C.温度变化,平衡发生移动,化学平衡常数一定变化,故C错误;
D.平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,已知K=$\frac{{c}^{2}(C{O}_{2})•{c}^{6}({H}_{2})}{{c}^{3}({H}_{2}O)•c(C{H}_{3}C{H}_{2}OH)}$,则对应的化学反应可以表示为:CH3CH2OH(g)+3H2O(g)?2CO2( g)+6H2(g),故D正确.
故选:D.
点评 本题考查化学平衡知识,题目难度中等,注意把握化学平衡常数的意义以及影响化学平衡移动的因素.


科目:高中化学 来源: 题型:选择题
| A. | 三种元素的最高正化合价中,Z的最大 | |
| B. | X、Y、Z不能形成共价化合物 | |
| C. | 原子半径:X>Y>Z | |
| D. | Y的最高价氧化物对应的水化物是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46 | B. | 40 | C. | 37.5 | D. | 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-丙醇的结构式:CH3CHOHCH3 | |
| B. | 丙烯分子的结构简式为 CH3CH CH 2 | |
| C. | 四氯化碳分子的电子式为: | |
| D. | 2-乙基-1,3-丁二烯的键线式: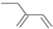 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能发电技术是将化学能转化为电能 | |
| B. | 集热技术是将太阳能转化为热能 | |
| C. | 光-热转化是目前技术最成熟、成本最低廉、应用最广泛的利用太阳能形式 | |
| D. | 化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
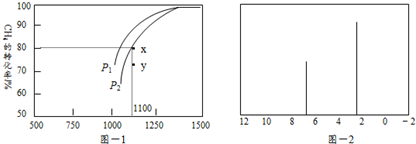
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒测得排水法收集制得的氢气体积为5.28 mL | |
| B. | 用两只250 mL的容量瓶配制0.1mol/L 500 mL的NaOH溶液 | |
| C. | 用托盘天平称得2.50g胆矾,受热充分失水后,固体质量减轻0.90g | |
| D. | 常温下,测得1molN2的质量为28g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com