
分析 Ⅰ.气体A可使澄清石灰水变浑浊,结合抗酸药的有效成分,知该气体为CO2.X中一定不含Si,因为硅酸盐中加入过量盐酸,会产生硅酸沉淀;
Ⅱ.X中一定不含Na,因为Na的焰色为黄色;
Ⅲ.根据题给信息知调节pH至5~6时生成的白色沉淀为Al(OH)3;
Ⅳ.加入过量NaOH溶液,沉淀B完全溶解,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O;
Ⅴ.加入NaOH溶液调节pH至12,有白色沉淀产生,则沉淀C为Mg(OH)2.
综上所述:由于n(CO2):n[Al(OH)3]:n[Mg(OH)2]=1:1:3,则CO32-、Al3+、Mg2+的物质的量之比为1:1:3,结合电荷守恒,则CO32-、Al3+、Mg2+、OH-的物质的量之比为1:1:3:7,故X为Mg3Al(OH)7CO3.
解答 解:(1)气体A可使澄清石灰水变浑浊,结合抗酸药的有效成分,知该气体为CO2,故答案为:CO2;
(2)X中一定不含Si,因为硅酸盐中加入过量盐酸,会产生硅酸沉淀,一定不含Na,因为Na的焰色为黄色,故答案为:钠、硅;
(3)调节pH至5~6时生成的白色沉淀为Al(OH)3,NH3•H20为弱电解质,离子方程式中应写为化学式,故答案为:Al3++3NH3•H20═Al(OH)3↓+3NH4+;
(4)Al(OH)3为两性氢氧化物,能溶于强碱,加入过量NaOH溶液,Al(OH)3沉淀完全溶解,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(5)加入NaOH溶液调节pH至12,有白色沉淀产生,则沉淀C为Mg(OH)2,故答案为:Mg (OH)2;
(6)由于n(CO2):n[Al(OH)3]:n[Mg(OH)2]=1:1:3,则CO32-、Al3+、Mg2+的物质的量之比为1:1:3,结合电荷守恒,则CO32-、Al3+、Mg2+、OH-的物质的量之比为1:1:3:7,故X为Mg3Al(OH)7CO3.
故答案为:Mg3 Al(OH)7 CO3.
点评 本题考查抗酸药成分的探究实验,题目较为综合,本题易错点为第(6)题,根据质量守恒定律解答,题目难度中等.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 物质 | Fe2O3 | NH3 | Si | Na2O |
| 用途 | 作红色涂料 | 制硝酸 | 作半导体材料 | 作供氧剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁达尔现象可用区别胶体与溶液 | |
| B. | 胶体不稳定,在一定条件下会发生聚沉 | |
| C. | 胶体粒子能通过半透膜,不能通过滤纸 | |
| D. | 溶液、胶体、浊液的根本区别是分散质粒子直径的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
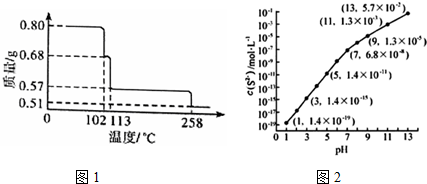
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
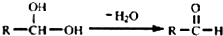

 .
. ;
; .
. (只写出一种即可)
(只写出一种即可)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
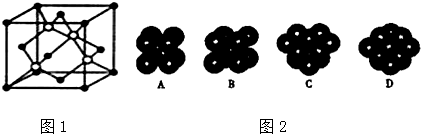
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛过量 | B. | Cu(OH)2过量 | ||
| C. | 用CuSO4制取Cu(OH)2时,NaOH要过量 | D. | 用CuSO4制取Cu(OH)2时,CuSO4要过量 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:选择题
对于可逆反应2AB3(g) 2A(g)+3B2(g)△H>0 下列图象不正确的是
2A(g)+3B2(g)△H>0 下列图象不正确的是
A. B.
B.
C.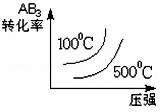 D.
D.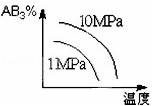
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com