
【题目】100 mL 6 mol·L-1 H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量 ( )
A.碳酸钠溶液B.氨水C.硫酸钾溶液D.硝酸钠溶液
科目:高中化学 来源: 题型:
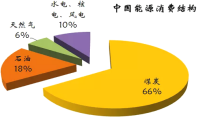
【题目】下图为我国目前的能源消费结构图:
(1)由图中数据可知,一定时期内,我国的能源结构仍以煤碳为主,但直接燃烧煤炭的弊端是____。
(2)将煤转化为水煤气可有效降低煤对环境的破坏性,能量变化如图所示:
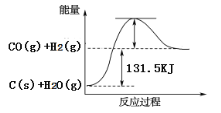
根据以上数据,写出该反应的热化学方程式_________________;
(3)甲醇是重要的化学工业基础原料和清洁液体燃料。将煤液化将克服直接将煤作为燃料的不足。其反应原理为CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g)。
CH3OH(g) +H2O(g)。
①在适当的催化剂作用下,该反应能自发进行。则该反应ΔH______0(填“>”、“<”或“=”)
②在体积一定的密闭容器中发生该反应,达到平衡后升高温度,下列说法正确的是______。
A.平衡正向移动 B.达到新的平衡后体系的压强增大
C.H2的转化率增大 D.体系的密度增大
③下列叙述能说明此反应达到平衡状态的是_______。(填字母)
a.混合气体的平均相对分子质量保持不变 b.1 mol CO2生成的同时有3 mol H—H键断裂
c.CO2的转化率和H2的转化率相等 d.混合气体的密度保持不变
④在相同起始温度(500℃)、起始体积相同(2L)的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:
反应时间 | CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
反应Ⅰ:恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
反应Ⅱ:恒温恒压 | 0 min | 1 | 3 | 1 | 1 |
反应Ⅲ:绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
查阅资料发现500℃时该反应的平衡常数为2.5。则反应Ⅰ在10min时v正______v逆,则反应均达到平衡时,反应Ⅰ、Ⅱ对比H2的百分含量关系w%Ⅰ(H2)______w%Ⅱ(H2),反应Ⅰ、Ⅲ对比:平衡时CH3OH的浓度c(I)_______c(Ⅲ)(本小题均用“>”、“<”或“=”填空)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
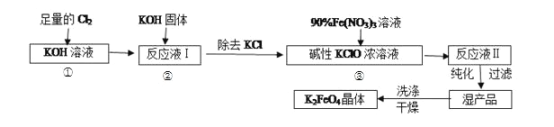
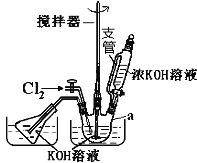
已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
③K2FeO4在水溶液中易水解:4FeO42+10H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2↑
4Fe(OH)3(胶体)+8OH-+3O2↑
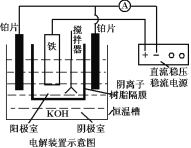
回答下列问题:实验室可利用如图装置完成流程①和②
(1)写出工业上制取 Cl2 的化学方程式_____;恒压滴液漏斗支管的作用_____,两水槽中的水为__________(填“热水”或“冷水”).
(2)反应一段时间后,停止通氯气,再往仪器 a 中加入浓 KOH 溶液的目的是_____;
A.为下一步反应提供碱性的环境
B.使 KClO3 转化为 KClO
C.与溶液 I 中过量的Cl2继续反应,生成更多的KClO
D.KOH 固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出 K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子方程式为:_________________。
(4)用重结晶法提纯粗产品:将粗产品先用 KOH 稀溶液溶解,再加入饱和的 KOH溶液,冷却结晶,过滤,用少量异丙醇洗涤,最后低温真空干燥。
①洗涤粗品时选用异丙醇而不用水的理由是_____________。
②如何判断 K2FeO4 晶体已经洗涤干净________________。
(5)从环境保护的角度看,制备 K2FeO4 较好的方法为电解法,其装置如图电解过程中阳极的电极反应式为___________。
(6)FeO42-在水溶液中的存在形态如图所示。下列说法正确的是______________。
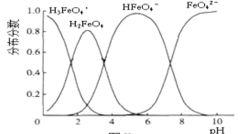
A.不论溶液的酸碱性如何变化,铁元素都有 4 种存在形态
B.向 pH=10的这种溶液中加硫酸至 pH=2,HFeO4-的分布分数逐渐 增大
C.向 pH=6 的这种溶液中加 KOH 溶液,发生反应的离子方程式为HFeO4-+OH-=FeO42- +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为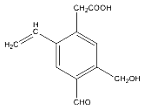 ,则下列说法错误的是( )
,则下列说法错误的是( )
A. 该有机物的分子式为C12H12O4
B. 1mol该有机物最多能与4mol H2反应
C. 该有机物可与碳酸氢钠溶液反应放出CO2,生成2.24L CO2(标况下)需要0.1mol该有机物
D. 该有机物可发生氧化、取代、加成和还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中能大量共存的离子组是( )
A. K+、NO3-、Cu2+ B. K+、OH﹣、Na+
C. Ba2+、SO42-、Na+ D. Ca2+、CO32-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可降解高分子材料P的结构为:
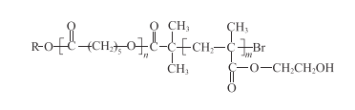
下图是P的合成路线

(1)B的结构简式是_________。
(2)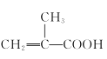 中的官能团是_________、_________。
中的官能团是_________、_________。
(3)试剂a是_________。
(4)③的化学方程式是_________。
(5)⑥的反应类型是_________。
(6)当④中反应物以物质的量之比1:1发生反应时,反应⑤的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 纯盐酸 | 水煤气 | 硫酸 | 干冰 |
B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
C | 胆矾 | 氢硫酸 | 铁 | 碳酸钙 |
D | 过氧化钠 | 氯水 | 氯化铜 | 碳酸钠 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为1 L的密闭容器中(体积不变)充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
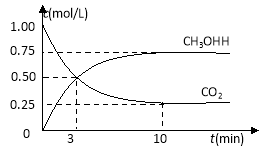
A.3min前v正>v逆,3min后v正<v逆
B.进行到3分钟时,正反应速率和逆反应速率相等
C.10分钟后容器中各物质浓度不再改变
D.达到平衡后,升高温度,正反应速率增大、逆反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com