
分析 用惰性电极电解胆矾溶液一段时间,加入0.1mol 的Cu(OH)2可恢复溶液原况(浓度、成分),加入的物质相当于CuO.H2O,阳极上氢氧根离子失电子、阴极上铜离子得电子、氢离子得电子,所以有两个电解过程,第一步生成O2和Cu、第二步生成O2和H2,根据阳极上析出氧气物质的量计算转移电子物质的量.
解答 解:用惰性电极电解胆矾溶液一段时间,加入0.1mol 的Cu(OH)2可恢复溶液原况(浓度、成分),加入的物质相当于CuO.H2O,阳极上氢氧根离子失电子、阴极上铜离子得电子、氢离子得电子,所以有两个电解过程,第一步生成O2和Cu、第二步生成O2和H2,阳极反应式为4OH--4e-=O2↑+2H2O,根据O原子守恒得n[Cu(OH)2]=n(O2)=0.1mol,转移电子物质的量=4n(O2)=4×0.1mol=0.4mol,故答案为:0.4mol.
点评 本题以电解原理为载体考查物质的量有关计算,明确各个电极上发生的反应是解本题关键,注意转移电子和氧气的关系,易错点是阴极析出物质的判断,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
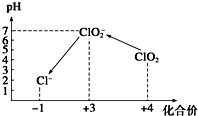 ClO2气体是一种常用的消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种常用的消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的分解反应是放热反应 | |
| B. | 氢气是一级能源 | |
| C. | 大量使用氢气作燃料会造成温室效应 | |
| D. | 若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可以改善生存环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na→NaOH→Na2CO3→NaCl | B. | Cu→CuO→Cu (OH)2→CuCl2 | ||
| C. | Mg→MgCl2→Mg(OH)2→MgSO4 | D. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温室效应:一氧化碳 | B. | 光化学烟雾:氮的氧化物 | ||
| C. | 酸雨:二氧化硫 | D. | 臭氧层破坏:氟氯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com