
| A. | ①④ | B. | ②③ | C. | ②③④ | D. | 只有④ |
分析 可逆反应A(s)+2B(g)?C(g)+D(g)是一个反应前后气体体积不变、质量变化的可逆反应,当该反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量不变以及由此引起的一系列物理量不变,据此分析解答.
解答 解:①该反应中A为固态,则反应后恰好气体质量发生变化,容器容积不变,则反应过程中混合气体的密度为变量,当混合气体的密度不变时,表明正逆反应速率相等,达到平衡状态,故①正确;
②该反应为气体体积不变的反应,则反应过程中压强始终不变,不能根据压强判断平衡状态,故②错误;
③该反应前后气体体积不变,则反应过程中物质的量始终不变,不能根据物质的量判断平衡状态,故③错误;
④B物质的量浓度不变,表明正逆反应速率相等,各组分浓度不再变化,达到平衡状态,故④正确;
故选A.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,注意该反应中气体质量为变量,气体物质的量不变,为易错点,试题有利于提高学生灵活应用基础知识的能力.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解水生成氢气和氧气时,电能转化为化学能 | |
| B. | 煤燃烧时,化学能主要转化为热能 | |
| C. | 绿色植物进行光合作用时,太阳能转化为化学能 | |
| D. | 白炽灯工作时,化学能主要转化为光能 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

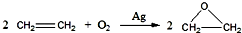
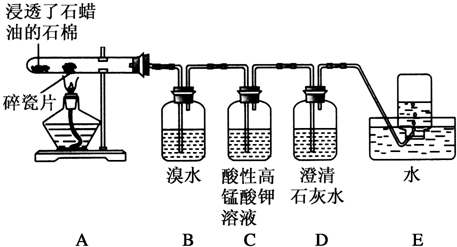
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
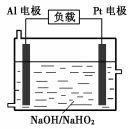 已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在.目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:
已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在.目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1的NaCl溶液 | B. | 75 mL 2 mol•L-1 NH4Cl溶液 | ||
| C. | 150 mL 3 mol•L-1的KCl溶液 | D. | 75 mL 3 mol•L-1的FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 淀粉溶液 | 实验目的 | ||
| c(KI) | V | c(H2SO4) | V | ||||
| 1 | 298K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | 1组和2组探究②0.2mol/L温度对该反应速率的影响;1组和3组探究反应物浓度对该反应速率的影响 |
| 2 | 308K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | |
| 3 | 298K | 1mol/L | 5mL | ① | 5mL | 3滴 | |
| 实验方案 | 预期实验现象与结论 |
| 取少量碘水于试管中,滴入几滴淀粉溶液,然后逐滴加入1mol/LKOH溶液,观察现象 | 若蓝色不褪色,则假设二正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 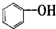 属于醇类化合物 属于醇类化合物 | B. | 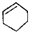 属于芳香族化合物 属于芳香族化合物 | ||
| C. | 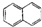 属于脂环化合物 属于脂环化合物 | D. | CH3CH(CH3)2属于链状化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com