
分析 (1)弱酸根离子水解显碱性;
(2)弱碱离子水解显碱性;
(3)与氢离子、氢氧根离子均不反应的离子,可大量共存;
(4)与酸、碱均反应的离子,为酸式酸根离子,不能大量存在.
解答 解:(1)S2-、SO32-、AlO2-、HCO3-属于弱酸根离子,水解显碱性,
故答案为:S2-、SO32-、AlO2-、HCO3-;
(2)NH4+、Al3+、Fe3+均属于弱碱阳离子,水解显酸性,
故答案为:NH4+、Al3+、Fe3+;
(3)既能在酸性较强溶液里、又能在碱性较强的溶液里大量存在的离子,是和氢离子、氢氧根离子都不反应的离子,强酸的酸根离子和强碱的阳离子,为Na+、SO42-、Cl-,
故答案为:Na+、SO42-、Cl-.
(4)与酸、碱均反应的离子,为弱酸的酸式酸根离子,不能大量存在,即HCO3-既不能在酸性较强的溶液中大量存在,又不能在碱性较强的溶液中大量存在,
故答案为:HCO3-.
点评 本题考查盐类水解及离子共存,把握盐类水解原理及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
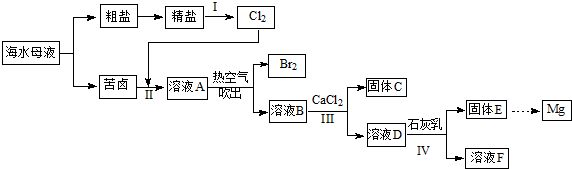
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑥⑦ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与水反应 | B. | 与氢氧化钠溶液反应 | ||
| C. | 与硫酸反应 | D. | 与前三种物质均能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.打磨磁石制指南针 | B.烧结粘土制陶瓷 | C.湿法炼铜 | D.铁的冶炼 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
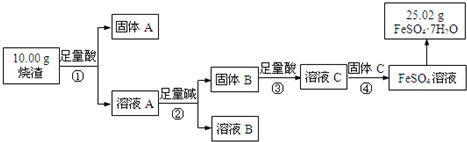
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| I1 | I2 | I3 | I4 | … | |
| 电离能(kJ/mol) | 738 | 1451 | 7733 | 10540 | … |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com