
【题目】过渡金属的单质及化合物很多有催化性能,氯化铜、氯化亚铜经常用作有机合成催化剂。实验室中用氯气与粗铜(杂质只有Fe)反应,制备铜的氯化物的流程如下。
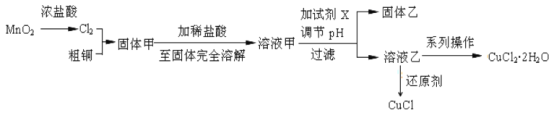
查阅资料:
氯化亚铜:白色微溶于水,在干燥空气中稳定,受潮则易变蓝到棕色,在热水中迅速水解生成氧化铜水合物而呈红色。
氯化铜:从水溶液中结晶时,在26~42℃得到二水物,在15℃以下得到四水物,在15~25.7℃得到三水物,在42℃以上得到一水物,在100℃得到无水物。
(1)现用如图所示的实验仪器及药品制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。
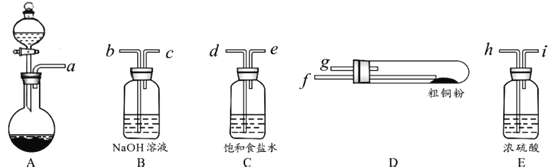
①按气流方向连接各仪器接口顺序是:a→_____、_____→h、i→_____、_____→_____。
②本套装置有两个仪器需要加热,加热的顺序为先_____后_____。
(2)分析流程:
①固体甲需要加稀盐酸溶解,其理由是_____;
②溶液甲可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)_____。
a Cu(OH)2 b NH3·H2O c CuO d CuSO4
查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________。(提示:lg2=0.3)
③完成溶液乙到纯净CuCl2·2H2O晶体的系列操作步骤为:加少量盐酸、蒸发浓缩、________、_______、洗涤、干燥。
(3)向溶液乙中加入适当的还原剂(如SO2、N2H4、SnCl2等),并微热得到CuCl沉淀,写出向乙溶液加入N2H4(氧化产物为无毒气体)的离子方程式:____________。
【答案】d e f g b A D 抑制氯化铜、氯化铁水解 ac 4 3.3(或3+lg2) 冷却到26~42℃结晶 过滤 4Cu2+ + 4Cl- + N2H4![]() 4CuCl↓ + N2↑+ 4H+
4CuCl↓ + N2↑+ 4H+
【解析】
⑴①A装置制取氯气,B除掉尾气,C除掉氯气中HCl杂质,D氯气与铜反应,E除掉氯气中水;②先反应生成氯气,不能先加热D,先加热会使铜与氧气反应。
⑵①固体甲是氯化铜和氯化铁的混合物,因此加稀盐酸溶解,溶解抑制氯化铜、氯化铁水解;②溶液甲可加试剂X用于调节pH以除去氯化铁杂质,应选择要保留的铜离子对应的难溶的物质;设溶液中CuSO4的浓度为3.0 mol·L-1,先算氢氧根浓度,再酸氢离子浓度和pH,Fe3+完全沉淀时先根据溶度积算氢氧根浓度,再酸氢离子和pH;③根据题中意思要得到纯净CuCl2·2H2O晶体要冷却到26~42℃结晶。
⑶向溶液乙中加入适当的还原剂N2H4,并微热得到CuCl沉淀和氮气。
⑴①A装置制取氯气,B除掉尾气,C除掉氯气中HCl杂质,D氯气与铜反应,E除掉氯气中水,因此按气流方向连接各仪器接口顺序是:a→d、e→h、i→f、g→b,故答案为:d;e;f;g;b。
②先反应生成氯气,不能先加热D,先加热会使铜与氧气反应,因此加热的顺序为先A后D,故答案为:A;D。
⑵①固体甲是氯化铜和氯化铁的混合物,因此加稀盐酸溶解,溶解抑制氯化铜、氯化铁水解,故答案为:抑制氯化铜、氯化铁水解。
②溶液甲可加试剂X用于调节pH以除去氯化铁杂质,应选择要保留的铜离子对应的难溶的物质即氢氧化铜、氧化铜、碱式碳酸铜、碳酸铜等,故答案为:ac。
设溶液中CuSO4的浓度为3.0 mol·L-1,![]() ,
,![]() ,
,![]() ,因此Cu(OH)2开始沉淀时溶液的pH为10,Fe3+完全沉淀
,因此Cu(OH)2开始沉淀时溶液的pH为10,Fe3+完全沉淀![]() ,
,![]() ,
,![]() ,因此Fe3+完全沉淀时溶液的pH=lg5×10-4 = 4-lg5 = 3.3,故答案为:3.3。
,因此Fe3+完全沉淀时溶液的pH=lg5×10-4 = 4-lg5 = 3.3,故答案为:3.3。
③完成溶液乙到纯净CuCl2·2H2O晶体的系列操作步骤为:加少量盐酸、蒸发浓缩、冷却到26~42℃结晶、过滤、洗涤、干燥,故答案为:冷却到26~42℃结晶;过滤。
⑶向溶液乙中加入适当的还原剂N2H4,并微热得到CuCl沉淀和氮气,因此向乙溶液加入N2H4的离子方程式:4Cu2+ + 4Cl- + N2H4![]() 4CuCl↓ + N2↑+ 4H+,故答案为:4Cu2+ + 4Cl- + N2H4
4CuCl↓ + N2↑+ 4H+,故答案为:4Cu2+ + 4Cl- + N2H4![]() 4CuCl↓ + N2↑+ 4H+。
4CuCl↓ + N2↑+ 4H+。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】为探究某矿物X(仅含三种元素)的组成与性质,设计并完成了如图实验:
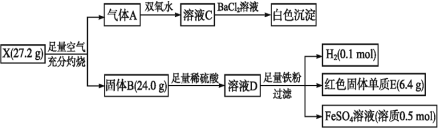
请回答:
(1)X的化学式为_____。
(2)X与空气中O2反应生成A和B的化学方程式为_____。
(3)写出气体A与溶液D反应的离子方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,LiFePO4是锂离子电池的正极材料。用含锂废渣(主要金属元素的含量:Li 8.50%、Ni 6.55%、Mg 13.24%)制备Li2C2O4,并用其制备LiFePO4部分工艺流程如图(该流程可能造成水体砷污染):
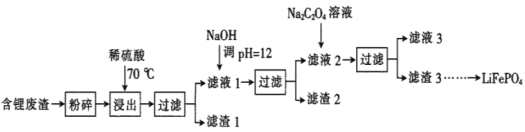
已知:滤液1、滤液2中部分离子的浓度(g·L-1):
Li+ | Ni2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.78×10-3 |
I.制备Li2C2O4
(1)滤渣2的主要成分有__(填化学式)。
(2)Na2C2O4溶液中各离子的浓度由大到小顺序为__。
(3)写出加入Na2C2O4溶液时发生反应的离子方程式:__。
Ⅱ.制备LiFePO4
(4)将电池极Li2C2O4和FePO4置于高温下反应生成LiFePO4和一种温室气体,该反应的化学方程式是___。
(5)LiFePO4需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是__(任写一点)。
(6)我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的As(Ⅴ),其机制模型如图,其中零价铁与过硫酸钠反应的离子方程式是__。在该模型中得到的铁砷共沉淀物经灼烧(无元素化合价变化)后得到一种磁性化合物,化学式为Fe7As2O14,该物质中二价铁与三价铁的个数比为__。
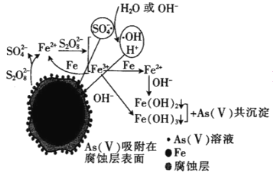
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
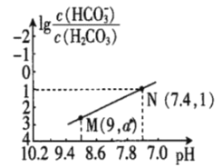
A.25℃时,H2CO3的一级电离K(H2CO3)=1.0×10-6.4
B.图中a=2.6
C.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.M点溶液中:c(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】增塑剂DCHP可由环己醇制得。DCHP和环己醇的结构简式如图所示,下列说法错误的是( )
![]()
环己醇
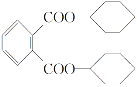
DCHP
A. DCHP的分子式为C20H26O4
B. 环己醇分子中所有碳原子不可能共平面
C. DCHP的一氯取代物有5种
D. DCHP通过取代反应可以得到环己醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对工业污泥中的铬元素回收与再利用的工艺如图(已知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):
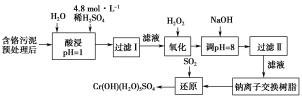
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH如表所示:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7 | — | — | — |
沉淀完全时的pH | 3.2 | 9 | 11.1 | 8 | 9(>9溶解) |
(1)实验室用98%(密度为1.84 g·cm-3)的浓硫酸配制200 mL 4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________mL(保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒外,还需______。
(2)过滤操作时,需要对沉淀进行洗涤,洗涤沉淀的方法是__________。
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离;另一方面是__________。(用离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是________。
(5)钠离子交换树脂的原理为Mn++nNaR![]() MRn+nNa+,被交换的杂质离子是________。
MRn+nNa+,被交换的杂质离子是________。
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):
____Na2Cr2O7+____SO2+___ ___=___Cr(OH)(H2O)5SO4+___Na2SO4。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用下图所示电解装置吸收和转化SO2(A、B均为惰性电极)。下列说法正确的是
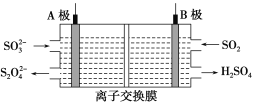
A.A电极接电源的正极
B.A极区溶液的碱性逐渐增强
C.本装置中使用的是阴离子交换膜
D.B极的电极反应式为SO2+2e-+2H2O ===![]() +4H+
+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com