
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150 mL 4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24 L NO(标准状况下),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为 ( )。
A.0.21 mol B.0.25 mol
C.0.3 mol D.0.35 mol
科目:高中化学 来源: 题型:
乙酸橙花酯是一种食用香料,其结构简式如右图所示,关于该有机物的下列叙述中正确的是( )
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,
且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A.①②③ B.①②⑤ C.①②⑤⑥ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是 ( )。
A.将NaHCO3固体加入新制氯水,有无色气泡(H+)
B.使红色布条褪色(HClO)
C.滴加AgNO3溶液生成白色沉淀(Cl-)
D.向FeCl2溶液中滴加氯水后,再滴加KSCN溶液,发现呈红色(HCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图装置来分离CO2和CO混合气体并干燥,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为 ( )。

| 甲 | 乙 | 丙 | |
| A | 饱和NaHCO3溶液 | 12 mol·L-1盐酸 | 18.4 mol·L-1 H2SO4 |
| B | 饱和Na2CO3溶液 | 2 mol·L-1 H2SO4 | 饱和NaOH溶液 |
| C | 饱和NaOH溶液 | 2 mol·L-1 H2SO4 | 18.4 mol·L-1 H2SO4 |
| D | 18.4 mol·L-1 H2SO4 | 饱和NaOH溶液 | 18.4 mol·L-1 H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子形成沉淀或沉淀的溶解与溶液pH的关系如下表) ( )。
| 离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
| 开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
| 完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |

查看答案和解析>>
科目:高中化学 来源: 题型:
“东方之冠”的主体结构是用国产Q460钢制成的。下列有关Q460钢的说法可能不正确的是 ( )。

A.硬度比纯铁大 B.性能优于普通钢
C.熔点比纯铁高 D.属于合金
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学设计了如下实验测量m g铜银合金样品中铜的质量分数:

下列说法中不正确的是 ( )。
A.合金的熔点比其成分金属低,通常比成分金属具有更优良的金属特性
B.铜银都能与稀硝酸反应,收集到的V L气体可能全为NO
C.操作Ⅰ是过滤,操作Ⅱ是洗涤,操作Ⅲ应是烘干
D.根据反应收集到的气体体积可以计算铜和银的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| Ⅰ | 向2 mL 1 mol·L-1 FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色,并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH________7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
①甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,请用化学平衡移动原理解释溶液呈红褐色的原因:___________________________。
②乙同学认为可能是发生了氧化还原反应,其中Fe3+→Fe2+;请写出Fe3+跟SO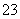 反应的离子方程式_____________________________________________
反应的离子方程式_____________________________________________
________________________________________________________。
乙同学查阅资料得知:
| 1.Fe2+与SO 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。 |
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1 mol·L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
①经检验步骤Ⅲ中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是________(填字母)。
a.K3[Fe(CN)6]溶液 b.KSCN溶液 c.KMnO4溶液
②请用离子方程式和必要的文字说明步骤Ⅲ中出现红褐色的原因____________________。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.根据1H核磁共振谱图可以推知有机物分子中有几种不同类型的氢原子
B.红外光谱是用高能电子流等轰击样品分子,使分子失去电子变成分子、离子或碎片离子
C.元素分析仪具有快速、微量、精确等特点
D.通过红外光谱可以测知有机物所含的官能团
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com