
| A、大理石和稀盐酸反应 CO32-+2H+═CO2↑+H2O |
| B、铜和稀硝酸反应 3Cu+8H++2 NO3-═3Cu2++2NO↑+4H2O |
| C、金属钠和水反应 Na+H2O═Na++2OH-+H2↑ |
| D、氧化铝和烧碱溶液反应 A12O3+2OH-═A1O2-+H2O |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入 | 存在Fe3+ | |
| 取少量除尽Ag+后的溶液于试管中,加入1~2滴KMnO4溶液,振荡 | 存在Fe2+ |
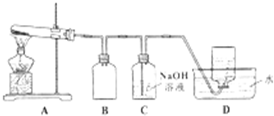
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、64g氧气中含氧分子数为2NA |
| B、1.7gOH-中所含的电子数为NA |
| C、49g硫酸中所含氧原子数为2NA |
| D、58.5g氯化钠中所含的离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
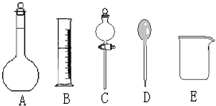 我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL 0.1mol?L-1的盐酸溶液.
我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL 0.1mol?L-1的盐酸溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com