


科目:高中化学 来源: 题型:
| A、9~11之间;0.1 |
| B、9~11之间;0.05 |
| C、12~13之间;0.2 |
| D、13;0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
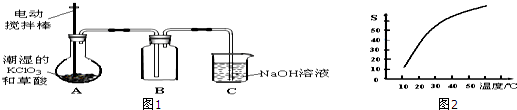
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸 |
| B、FeCl3 |
| C、Fe(NO3)3 |
| D、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 乙醚 |
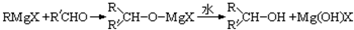 (R,R′可以是相同的烃基,也可能是不同的烃基)现用乙烯和适当的无机物合成乙酸异丁酯
(R,R′可以是相同的烃基,也可能是不同的烃基)现用乙烯和适当的无机物合成乙酸异丁酯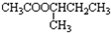 的过程如图(反应条件和部分产物没有列出):
的过程如图(反应条件和部分产物没有列出):
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇、丙醇 |
| B、乙醇、乙二醇 |
| C、1-丙醇、丙二醇 |
| D、乙烯、丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锂离子电池充电时电池反应为C6Li+Li1-xMO2=LiMO2+C6Li1-x |
| B、电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量小,比能量最大 |
| C、锂离子电池放电时电池内部Li+向负极移动 |
| D、锂离子电池充电时阴极反应为LiMO2-xe-=Li1-xMO2+xLi+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com