
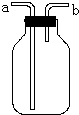
 (1)如图的装置在实验室中用途比较广泛:
(1)如图的装置在实验室中用途比较广泛:| n |
| V |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液 | B、悬浊液 |
| C、乳浊液 | D、胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
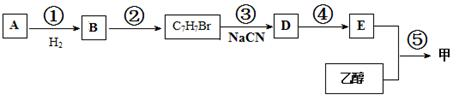
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F、G是原子序数依次增大的前四周期的元素,其中A是形成化合物最多的元素之一,并且其常见化合价为+1和-1,B元素基态原子价电子排布式为nsnnpn,D是地壳中含量最大的元素,E的氢氧化物具有两性,F3+的3d能级为半充满,GD是黑色固体,G2D为砖红色固体,回答下列问题:
A、B、C、D、E、F、G是原子序数依次增大的前四周期的元素,其中A是形成化合物最多的元素之一,并且其常见化合价为+1和-1,B元素基态原子价电子排布式为nsnnpn,D是地壳中含量最大的元素,E的氢氧化物具有两性,F3+的3d能级为半充满,GD是黑色固体,G2D为砖红色固体,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(如图中的△H表示生成lmol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(如图中的△H表示生成lmol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:
 我国在反兴奋剂问题上的立场是坚决支持“人文奥运”的.某种兴奋剂的结构如图所示.关于它的叙述正确的是( )
我国在反兴奋剂问题上的立场是坚决支持“人文奥运”的.某种兴奋剂的结构如图所示.关于它的叙述正确的是( )| A、它的分子式为C20H22O3 |
| B、它易溶于水 |
| C、它的分子中共平面的碳原子最多有16个 |
| D、1mol它最多可与7molH2和含4mol Br2的溴水发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
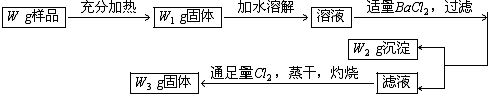
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com