
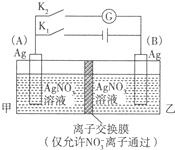
 利用如图装置进行实验,甲乙两池均为1mol?L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强).下列说法不正确的是( )
利用如图装置进行实验,甲乙两池均为1mol?L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强).下列说法不正确的是( )| A、闭合K1,断开K2后,A电极增重 |
| B、闭合K1,断开K2后,乙池溶液浓度上升 |
| C、断开K1,闭合K2后,NO3-向B电极移动 |
| D、断开K1,闭合K2后,A电极发生氧化反应 |


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
| A、原子序数X<Y |
| B、原子半径X>Y |
| C、原子的最外层电子数X>Y |
| D、元素的最高正价X<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
 镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题:
镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气象环境报告中的“PM2.5”是对一种新分子的描述 |
| B、地沟油的主要成分是油脂,其组成与汽油、煤油不相同 |
| C、“玉兔号”月球车太阳能电池帆板的材料是二氧化硅 |
| D、高铁车厢采用的铝合金材料强度大、质量轻,不与氧气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、风力发电 | B、汽车尾气 |
| C、煤炭燃烧 | D、建筑扬尘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓度均为0.1mol?L-1的下列溶液,pH由大到小的排列顺序为:NaOH>Na2CO3>(NH4)2SO4>NaHSO4 |
| B、为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C、常温下,将pH=3的醋酸溶液稀释到原体积的10倍,稀释后溶液的pH=4 |
| D、常温下KSP(AgCl)=1.5×10-4,此时将足量氯化银固体分别投入相同体积的①蒸馏水②0.1mol/L盐酸③0.1mol/L氯化镁溶液④0.1mol/L硝酸银溶液中,则溶液中Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol Fe2+与含0.5 mol H2O2溶液反应,转移NA个电子(NA表示阿伏加德罗常数) | ||
B、常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中
| ||
| C、复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是2 Fe3++3SO42-+3Ba2++6 OH-=3BaSO4↓+2Fe(OH)3↓ | ||
| D、向2mL 0.1mol/L的硝酸银溶液中滴加几滴0.1mol/L氯化钠溶液,产生白色沉淀,再滴加几滴硫化钠溶液,产生黑色沉淀,说明氯化银能转化为更难溶的硫化银 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴水溶液Na+ K+ NO3- CH3CHO |
| B、氢氧化钠溶液AlO2- K+ Cl- NO3- |
| C、氢氧化铁胶体H+ K+ S2- Cl- |
| D、高锰酸钾溶液H+ Na+ SO42- CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:

| v(N2) |
| v(O2) |
| 2 |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com