
| A. | 铜片浸入氯化铁溶液中:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 一小块钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 稀盐酸滴入硝酸银溶液中:Ag++Cl-═AgCl↓ | |
| D. | 烧碱溶液吸收氯气:Cl2+2OH-═Cl-+ClO-+H2O |
分析 A.电荷不守恒;
B.钠和水反应生成氢氧化钠和氢气;
C.稀盐酸滴入硝酸银溶液,反应生成AgCl沉淀;
D.氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水.
解答 解:A.电荷不守恒,应为Cu+2Fe3+═Cu2++2Fe2+,故A错误;
B.钠和水反应生成氢氧化钠和氢气,离子方程式为2Na+2H2O═2Na++2OH-+H2↑,故B正确;
C.稀盐酸滴入硝酸银溶液,反应生成AgCl沉淀,反应的离子方程式为Ag++Cl-═AgCl↓,故C正确;
D.氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O,故D正确.
故选A.
点评 本题考查离子方程式的书写以及正误判断,为高考常见题型,侧重于离子反应的综合理解和运用的考查,注意把握离子反应的特点以及离子方程式的正误判断方法,难度不大.


科目:高中化学 来源: 题型:推断题
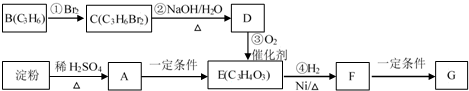
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④⑤ | C. | ②③⑤ | D. | ②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
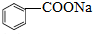 ,缩写为NaA)可用作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11,在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11,在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )| A. | 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低 | |
| B. | 提高CO2充气压力,饮料中c(A-)不变 | |
| C. | 当pH为5.0时,饮料中$\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| D. | 碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO3-)+c(CO32-)+c(OH-)-c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
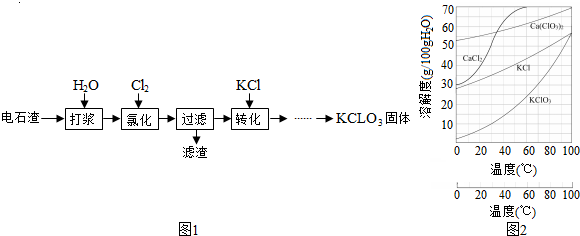
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
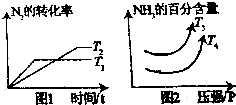 硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程
硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径最大的主族元素是④ | B. | 电负性最大的元素是① | ||
| C. | 第一电离能最小的元素是② | D. | ③的最高正化合价一定是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com