
氢气是清洁的能源,也是重要的化工原料,根据以下两种制氢方法。完成下列问题:
(1)方法一:H2S热分解法,反应式为:2H2S(g) 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H
在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为cmol/L),测定结果见右图,图中曲线a表示H2S的平衡转化率与温度关系,曲线表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
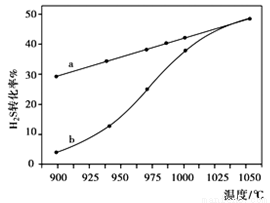
①△H______0,(“>”、“<”或“=”),
②若985℃时,反应经tmin达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=______(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因:______。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2.相关主要反应如下:
I:C(s)+H2O(g)═CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g) △H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)═CaCO3(s) △H=-178.3kJ/mol
①计算反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g)的△H=______;
CaCO3(s)+2H2(g)的△H=______;
若K1、K2、K3分别为反应I、Ⅱ、Ⅲ的平衡常数,该平衡常数K=_____________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是______。(填字母编号)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是______。(填字母编号)
A.降低体系的温度
B.压缩容器的体积
C.适当增加水蒸气的通入量
D.增加CaO的量
③下图为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图。若反应达某一平衡状态时,测得c(H2O)=2c(H2)=2c(CO)=2mol/L,试根据H2O的体积百分含量变化曲线,补充完整CO的变化曲线示意图。

科目:高中化学 来源:2015-2016学年云南省高一下期中化学试卷(解析版) 题型:选择题
下列反应既属于氧化还原反应,又是吸热反应的是
A.锌粒与稀硫酸的反应 B.灼热的木炭与CO2的反应
C.乙醇在氧气中燃烧 D.Ba(OH)2·8H2O晶体与NH4Cl晶体反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.充分燃烧56g乙烯和环丙烷的混合气体,消耗O2的分子数为3NA
B.某密闭容器中有0.2 mol SO2和0.1 mol O2,在一定条件下充分反应,生成SO3分子数为0.2NA
C.60g甲醛和乙酸的混合物中氧原子数为2NA
D.1 mol有机物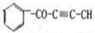 中最多有5NA个碳原子在一条直线上
中最多有5NA个碳原子在一条直线上
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:选择题
全钒液流电池是一种新型的绿色环保储能电池,工作原理如图所示,a、b均为惰性电极,放电时左槽溶液颜色由黄色变为蓝色。下列叙述正确的是( )
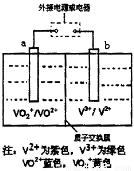
A.充电时右槽溶液颜色由紫色变为绿色
B.放电时,b极发生还原反应
C.电池的总反应可表示为VO2++V2++2H+ VO2++V3++H2O
VO2++V3++H2O
D.充电过程中,a极的反应式为VO2++2H++e-═VO2++H2O
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:选择题
下列化学用语正确的是
A.18O2-结构示意图: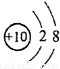
B.硝基苯的结构简式: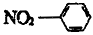
C.NaHSO4熔融时电离方程式:NaHSO4= Na++ HSO4-
D.模型 可表示甲烷分子或四氯化碳分子
可表示甲烷分子或四氯化碳分子
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第五次模拟理综化学试卷(解析版) 题型:选择题
原子结构决定元素的性质,下列说法中正确的是
A.Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小,
B.在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的其沸点也一定最高
C.第二周期元素的最高正化合价都等于其原子的最外层电子数
D.非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强
查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄冈市高三5月一模理综化学试卷(解析版) 题型:实验题
锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:

已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。(至少答两条)
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为
。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+) :c(Ni2+)= 。
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为 。(用含a、b、c的式子表达,无需化简)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古杭锦后旗奋斗中学高二下期中化学卷(解析版) 题型:选择题
pH=2和pH=4的两种稀硫酸,等体积混合后,下列结论正确的是( )
A.c(H+)=1×10-3 mol·L-1 B.c(OH-)=2×10-12 mol·L-1
C.pH=2.3 D.pH=3
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三考前训练二理综化学试卷(解析版) 题型:选择题
下列实验中,对应的现象以及解释或结论都正确且具有因果关系的是( )
选项 | 操作 | 现象 | 解释或结论 |
A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | Na2CO3溶液的pH较大 | 非金属性C<S |
B | 向盛有2ml0.1mol/L AgNO3溶液的试管中滴加一定量0.1mol/L NaCl溶液,再向其中滴加一定量0. 1mol/L KI溶液, | 先有白色沉淀生成,后又产生黄色沉淀 | Ksp(AgCl)> Ksp(AgI) |
C | 室温下,取相同大小、形状和质量的Cu粒分别投入0.1mol/L的稀硝酸和10.0mol/L的浓硝酸中 | Cu粒与浓硝酸反应比与稀硝酸反应剧烈 | 探究浓度对化学反应速率的影响 |
D | 用石墨做电极电解Mg(NO3)2、Cu(NO3)2的混合溶液 | 阴极上先析出铜 | 金属活动性:Mg>Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com