
 把1体积CH4和4体积Cl2组成的混合气体冲入大试管中,将此试管倒立在盛有Na2SiO3溶液的水槽里,放在光亮处.
把1体积CH4和4体积Cl2组成的混合气体冲入大试管中,将此试管倒立在盛有Na2SiO3溶液的水槽里,放在光亮处.分析 (1)氯气在光照条件下发生了取代反应,生成的物质有:CH3Cl(气体)、CH2Cl2、CHCl3、CCl4、HCl;
①生成的产物均无色;
②反应生成了氯化氢,氯化氢易溶于水;
③生成的CH2Cl2、CHCl3、CCl4常温下均为无色液体油状液滴;
(2)氯化氢是强酸,溶于水后与溶液中硅酸钠反应置换出硅酸,硅酸不溶于水;
(3)依据负原理书写化学反应方程式即可;
(4)根据甲烷的物质的量计算出四种取代产物的物质的量,再根据甲烷与氯气的取代反应特点计算出消耗氯气的物质的量.
解答 解:(1)CH4和Cl2光照发生反应:CH4+Cl2 $\stackrel{光照}{→}$CH3Cl+HCl,CH3Cl+Cl2 $\stackrel{光照}{→}$CH2Cl2+HCl,CH2Cl2+Cl2 $\stackrel{光照}{→}$CHCl3+HCl,CHCl3+Cl2 $\stackrel{光照}{→}$CCl4+HCl,生成CH3Cl(气体)、CH2Cl2、CHCl3、CCl4、HCl,
①生成的产物均无色,所以试管中气体颜色会变浅,故答案为:试管中气体颜色会变浅;
②因生成的HCl易溶于水,反应后,试管内气体压强减小,水位在试管内上升,故答案为:水位在试管内上升;
③因生成的HCl易溶于水,反应后,试管内上方有酸雾,由于生成的CH2Cl2、CHCl3、CCl4常温下均为无色液体,使试管壁上有油状液滴,故答案为:试管壁上有油状液滴;
(2)氯化氢是强酸,溶于水后与溶液中硅酸钠反应置换出硅酸,硅酸不溶于水,即有沉淀生成,故答案为:生成沉淀;
(3)①CH4与Cl2反应方程式为:CH4+Cl2 $\stackrel{光照}{→}$CH3Cl+HCl,故答案为:CH4+Cl2 $\stackrel{光照}{→}$CH3Cl+HCl;
②HCl与Na2SiO3溶液反应生成硅酸和氯化钠,反应方程式为:2HCl+Na2SiO3=2NaCl+H2SiO3↓,故答案为:2HCl+Na2SiO3=2NaCl+H2SiO3↓;
(4)1mol甲烷与氯气完全反应生成四种有机产物的物质的量相同,即分别生成了0.25molCH3Cl(气体)、CH2Cl2、CHCl3、CCl4,根据取代反应特点,每取代1molH原子,需要消耗1mol氯气,则总共消耗氯气的物质的量为:0.25mol+0.25mol×2+0.25mol×3+0.25mol×4=2.5mol,即1体积甲烷消耗2.5体积氯气,故答案为:2.5.
点评 本题考查了甲烷的取代反应原理,题目难度不大,注意掌握甲烷的化学性质,明确取代反应原理,(2)为易错点,注意反应产物与有机产物的不同及甲烷与氯气的取代反应特点.


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:解答题
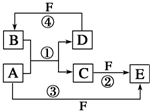 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出). ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.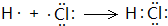 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2017届河南省南阳市高三上学期第三次月考化学试卷(解析版) 题型:推断题
某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42ˉ、SiO32ˉ、NO3ˉ中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。
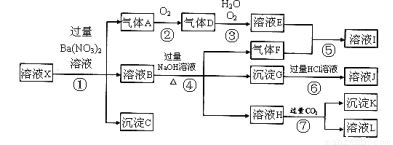
请回答下列问题:
(1)由强酸性条件即可判断溶 液X中一定不存在的离子有:
液X中一定不存在的离子有:
(2)溶液X中,关于NO3ˉ的判断一定正确的是;
a.一定有
B.一定没有
C.可能有
(3)产生气体A的离子方程式为;
(4)转化⑥发生反应的现象 为
为 ;
;
(5)转化④中产生H的离子方程式为;
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为;
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是。
①NaOH溶液,②KSCN溶液, ③石蕊试剂,④pH试纸,
③石蕊试剂,④pH试纸,
⑤KMnO4溶液,⑥氯水和KSCN的混合溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com