
【题目】下列现象与原子核外电子跃迁无关的是
A.激光B.焰火C.核辐射D.霓虹灯光
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】氮和碳一样也存在一系列氢化物如NH3、N2H4、N3H5、N4H6等。
(1)N3H5的电子式为_______。
(2)已知4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH1=a kJ/mol K1①;
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH2=b kJ/mol K2②;
写出N2与O2反应生成1 mol NO气体的热化学方式程式为________________________;
(3)已知NH3·H2O为一元弱碱,N2H4·H2O为二元弱碱,在水溶液中的一级电离方程式表示为N2H4·H2O+H2O![]() N2H5·H2O++OH-,则可溶性盐盐酸肼(N2H6Cl2)溶液中离子浓度由大到小的顺序为___________________________________。
N2H5·H2O++OH-,则可溶性盐盐酸肼(N2H6Cl2)溶液中离子浓度由大到小的顺序为___________________________________。
(4)如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器均发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
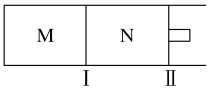
①向M、N中,各通入2 mol N2和6 mol H2。初始M、N容积相同,并保持温度不变。则到达平衡时H2的转化率α(H2)为M________N(填“>”“=”“<”)。
②若在某条件下,反应N2(g)+3H2(g)![]() 2NH3(g)在容器N中达到平衡,测得容器中含有1.0 mol N2、0.4 mol H2、0.2 mol NH3,此时容积为2.0 L。则此条件下的平衡常数为_______。
2NH3(g)在容器N中达到平衡,测得容器中含有1.0 mol N2、0.4 mol H2、0.2 mol NH3,此时容积为2.0 L。则此条件下的平衡常数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在人们的生活经常出现
(1)汽车尾气中NO生成过程的能量变化示意图如下:

该条件下,1mol N2和1molO2完全反应生成NO,会_______________(填“吸收”或“放出”)________kJ能量。
(2)一定温度下,在体积为0.5 L的恒容密闭容器中,氮的气态氧化物X和Y之间反应过程中各物质的物质的量与时间的关系如图所示。
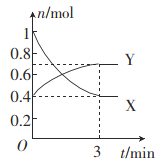
①该反应的化学反应方程式:______________________。
②在0~3 min内,用Y表示的反应速率为____________。
③下列叙述能说明该反应已达到化学平衡状态的是________(填字母)。
a.容器内压强不再发生变化
b.X的体积分数不再发生变化
c.容器内原子总数不再发生变化
d.相同时间内消耗nmolY的同时生成2nmol X
④反应达到平衡后,若降低温度,则υ(正)______,υ(逆)________。(填“增大”“减小”或“不变”)。
(3)反应 A(g)+3B(g)═2C(g)+3D(g)在四种不同情况下的反应速率分别为:
①υ (A)=0.015mol (Ls)﹣1 ②υ (B)=0.09mol (Ls)﹣1
③υ (C)=2.4mol (Lmin )﹣1 ④υ (D)=0.045mol (Ls)﹣1
该反应在四种不同情况下速率由大到小的顺序为(用序号填空)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应: A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是
2C(g)+D(g)已达平衡状态的是
A. 混合气体的压强B. 混合气体的密度
C. 3v逆(C)=2v正(B)D. 气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A、该反应的焓变为正值
B、恒温恒容下,增大压强,H2浓度一定减小
C、升高温度,逆反应速率减小
D、该反应化学方程式为CO+H2O=CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量是( )
A. 1.4gB. 2.2gC. 4.4gD. 在2.2g和4.4g之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图A、B是等体积容器,K是开关,活塞可以左右移动。在一定温度下,关闭K,向A中通入一定量的NO2。发生:2NO2(g)![]() N2O4(g);△H<0。则以下说法不正确的是
N2O4(g);△H<0。则以下说法不正确的是
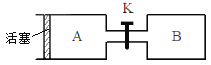
A. 保持活塞位置不变,打开K,体系中气体颜色先变浅、然后略加深
B. 打开K一会,再关闭它,向右推动活塞,最后A容器的气体颜色比B的浅
C. 保持活塞位置不变,打开K一会,再关闭它,把A容器加热,A中气体颜色比B中深
D. 打开K一会,再关闭它,向B中通入氩气,B中气体颜色不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温、常压和光照条件下,N2在催化剂表面与H2O发生反应:2N2(g)+6H2O(l) =4NH3(g)+3O2(g)。在2 L的密闭容器中,起始反应物用量相同,催化剂的使用情况也相同,控制不同温度分别进行4组实验,3 h后测定NH3的生成量,所得数据如下表:
实验级别 | 实验1 | 实验2 | 实验3 | 实验4 |
温度/K | 303 | 313 | 323 | 353 |
NH3生成量/106mol | 4.8 | 5.9 | 6.0 | 2.0 |
下列说法不正确的是
A. 温度为303 K时,在3 h内用氮气表示的平均反应速率为4×107mol·L1·h1
B. 实验1和实验3中,3 h内N2的转化率之比为4:5
C. 分析四组实验数据可得出,温度升高可加快反应速率,也可能减慢反应速率
D. 353 K时,可能是催化剂催化活性下降或部分水脱离催化剂表面,致使化学反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2 L的密闭容器内加入0.2 mol N2和0.6 mol H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
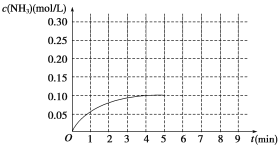
(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为__________。
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为_____________。
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_____(选填“大于”、“等于”、“小于”)二分之一倍的原体积,化学平衡常数________(选填“增大”、“减小”或“不变”)。
(4)在第5分钟末将容器的体积缩小一半,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在图中画出第5分钟末到达新平衡时NH3浓度的变化曲线_____。
(5)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com