
【题目】胶体的最本质的特征是( )
A. 丁达尔效应 B. 分散质颗粒的直径在1nm~100nm之间
C. 布朗运动 D. 可以通过滤纸
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】卤族元素随着原子序数的增大,下列递变规律正确的是( )。
A. 单质熔、沸点逐渐降低 B. 单质的氧化性逐渐增强
C. 原子半径逐渐增大 D. 气态氢化物稳定性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O],又称轻质碳酸镁。常利用菱镁矿(质量含量为碳酸镁90%,碳酸钙10%)碳化法制取:

(1)根据下列表格数据,选择消化反应的最佳温度__________;理由是___________________________。
消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为____________。
(3)流程图中__________和__________可以为碳化反应提供二氧化碳源。
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5mol·L-1时,可以认为完全除去。常温时当调节溶液PH为9.5时,此时Mn2+小于__________mol·L-1,不会沉淀出来。
物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为__________。
A.Ca(ClO)2 B.Cl2 C.H2O2 D.HNO3
③下列方案中,较好的为__________,理由是______________________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2作为氧化剂在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:
(1)定性分析:图甲可通过观察________________定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是_______________________。

(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为_______,检查该装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看__________,实验中需要测量的数据是__________。
(3)加入MnO2粉末于H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。

由D到A过程中,随着反应的进行反应速率逐渐_________。(填 “加快”或“减慢”),其变化的原因是_____________。(选填字母编号)
A.改变了反应的活化能 B.改变活化分子百分比
C.改变了反应途径 D.改变单位体积内的分子总数
(4)另一小组同学为了研究浓度对反应速率的影响,设计了如下实验设计方案,请帮助完成(所有空均需填满)。
实验编号 | T/K | 催化剂 | 浓度 |
实验1 | 298 | 3滴FeCl3溶液 | 10ml 2%H2O2 |
实验2 | 298 |
① 在实验2中依次填_______________、________________。
② 可得到的结论是浓度越大,H2O2 分解速率__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置进行铜的电解精炼实验(粗铜中有锌、铁、镍、银等杂质,部分导线未画出),下列说法正确的是( )

A. a应与c相连接,b应与d相连接
B. 电解一段时间,b与d两极析出物质的物质的量相等
C. 电解后Fe、Zn、Ag等杂质会沉积在装置Y的底部形成阳极泥
D. 电解过程中,Y装置中Cu2+的浓度始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
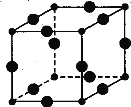
【题目】Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)N位于周期表中第 周期 族,与N3-含有相同电子数的三原子分子的空间构型是 。
(2)C、N、O三种元素的第一电离能由大到小的顺序为
(3)Cu+电子排布式为 ,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu20,试从结构角度解释高温下CuO何会生成Cu2O: 。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是 ,乙醛分子中H—C—O的键角 (填“大于”“等于”或“小于”)乙醇分子中的H—C一0的键角。
(5)[Cu(H20)4]2+为平面正方形结构,其中的两个H20被Cl-取代有两种不同的结构,试画出[Cu(H20)2(C1)2]具有极性的分子的结构式: 。
(6)Cu3N的晶胞结构如图,N3-的配位数为 ,Cu+半径为a pm,N3- 半径为b pm,Cu3N的密度为 g·cm-3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com