
 以下为五种有机物的有关信息,根据表中信息回答问题.
以下为五种有机物的有关信息,根据表中信息回答问题.| A | B | D | E | F |
| ①由C、H、O 三种元素组成的液体; ②与水任意比例互溶. |
其产量用来衡量一个国家的石油化工水平. | 比例模型为: |
①可用于除水垢 ②在低于16.6℃时,凝固成冰一样的晶体. |
由5个原子组成的10个电子的共价分子. |
 ,含碳碳双键,可与溴水发生加成反应;溴水的质量增加2.8g时,为乙烯的质量2.8g,则1,2-二溴乙烷的质量为2.8g+
,含碳碳双键,可与溴水发生加成反应;溴水的质量增加2.8g时,为乙烯的质量2.8g,则1,2-二溴乙烷的质量为2.8g+| 2.8g |
| 28g/mol |
 ;加成;18.8;
;加成;18.8; +HNO3(浓)
+HNO3(浓)| 浓H2SO4 |
| △ |
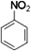 +H2O,生成物的结构简式为
+H2O,生成物的结构简式为 ,
, ;
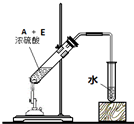
; ,图中有4处错误,分别为不能使用酒精喷灯,温度太高;缺少沸石,不能防止暴沸;导管不能深入液面下,不能防止倒吸,不能用水吸收,应利用饱和碳酸钠溶液,
,图中有4处错误,分别为不能使用酒精喷灯,温度太高;缺少沸石,不能防止暴沸;导管不能深入液面下,不能防止倒吸,不能用水吸收,应利用饱和碳酸钠溶液, ;4.
;4.


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 和
和 表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.
表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构、性质等信息 |
| X | 构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
| Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质 |
| Z | 与Y同周期,其最高价氧化物的水化物呈两性 |
| M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
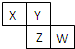 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )| A、气态氢化物的稳定性:Y>X |
| B、原子半径:W>Z>Y>X |
| C、X、Z、W的气态氢化物溶于水均呈酸性 |
| D、最高价氧化物对应水化物的酸性:Z>W>X |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlO2-、NH4+、I-、Cl- |
| B、NH4+、HCO3-、Cl-、K+ |
| C、K+、Ba2+、Cl-、SO42- |
| D、Cl-、Na+、NO3-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、电源B极是正极 |
| B、(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为1:2:2:2 |
| C、欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 |
| D、装置(丁)中X极附近红褐色不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com