
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
选项 叙述Ⅰ 叙述Ⅱ
A Cl2具有漂白性 Cl2能使干燥的有色布条褪色
B F元素非金属性很强 HF是一种强酸
C 浓H2SO4有强氧化性,SO2具有较强的还原性 但浓H2SO4却能干燥SO2
D 乙醇能杀菌消毒 医药上选用纯酒精进行消毒
A. A B. B C. C D. D
考点: 氯气的化学性质;浓硫酸的性质.
分析: A.氯气没有漂白性,次氯酸有漂白性;
B.F元素的非金属性很强,但HF是弱酸;
C.浓硫酸具有强氧化性,二氧化硫具有较强还原性,但浓硫酸和二氧化硫不反应;
D.乙醇能杀菌消毒,但医药上选用75%酒精进行消毒.
解答: 解:A.氯气没有漂白性,次氯酸有漂白性,氯气不能使干燥有色布条褪色,故A错误;
B.F元素的非金属性很强,F原子吸引电子能力较强,则HF不易电离出氢离子,所以HF是弱酸,故B错误;
C.浓硫酸具有强氧化性,二氧化硫具有较强还原性,但S元素+6、+4价之间没有中间价态,所以浓硫酸和二氧化硫不反应,可以用浓硫酸干燥二氧化硫,故C正确;
D.使用75%的酒精,能使组成细菌的蛋白质凝固,具有消毒杀菌作用,常用于医疗卫生方面的消毒,故D错误;
故选C.
点评: 本题考查元素化合物知识,为高频考点,明确物质性质是解本题关键,注意HF稳定性较强但属于弱酸,浓硫酸能干燥二氧化硫但不能干燥硫化氢,为易错点.


科目:高中化学 来源: 题型:
下列物质的电离方程式,正确的是( )
|
| A. | 加热NH4HCO3至熔融状态:NH4HCO3═NH4++HCO3‑ |
|
| B. | CO2通入水中得到H2CO3:H2CO3═2H++CO32‑ |
|
| C. | 醋酸钠溶于水:CH3COONa═CH3COO﹣+Na+ |
|
| D. | C2H5OH溶于水:C2H5OH═C2H5++OH﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
A. 1mol Fe与足量的盐酸反应,转移3nA个电子
B. 0.1mol•L﹣1的NaNO3溶液中含有0.1nA个NO3﹣
C. 常温下,34gNH3含有2nA个NH3分子
D. 常温常压下,22.4LNO2含有2nA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关实验现象.现在请你帮助该学生整理并完成实验报告.
(1)实验目的:
(2)实验用品:药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
仪器:① ;② (请填写两件主要的玻璃仪器)
(3)实验内容:
序号 实验方案 实验现象
① 将少量氯水滴入盛有少量NaBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色
② 将少量溴水滴入盛有少量KI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 加入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫色
(4)实验结论: .
(5)问题和讨论:请用结构理论简单说明得出上述结论的原因. .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释实验事实的离子方程式正确的是( )
A. 纯碱溶液显碱性的原因:CO32﹣+2H2O⇌H2CO3+2OH﹣
B. 氯化铁溶液腐蚀铜线路板Cu+Fe3+=Cu2++Fe2+
C. 稀硫酸与氢氧化钡溶液恰好中和:Ba2++OH﹣+H++SO42﹣=BaSO4↓+H2O
D. 氯气溶于水:Cl2+H2O=H++Cl﹣+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
A.B C.D.E.F六种物质的转化关系如图所示(反应条件和部分产物未标出)
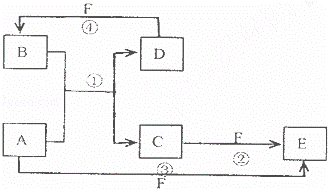
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A D反应都有红棕色气体生成,则A为 ,反应④的化学方程式为 .
(2)若A为常见的金属单质,D F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 .
(3)若A.D.F都是短周期非金属元素单质,且A.D所含元素同主族,A.F所含元素同周期,则反应①的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室配制500mL 0.1mol/L的NaOH溶液,有如下操作步骤:
①计算所需NaOH固体的质量并用托盘天平称取;
②将称量好的NaOH固体放入烧杯中,加入适量的蒸馏水溶解;
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶中并轻轻摇匀;
④继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,小心滴加蒸馏水至溶液凹液面与刻度线相切;
⑤塞紧容量瓶的塞子,充分摇匀.
回答下列问题:
(1)本实验中除用到容量瓶和烧杯外,还需要用到的玻璃仪器有: .
(2)实验中用托盘天平实际称取NaOH固体的质量是 .
(3)上述实验操作步骤缺少一步,请补充所缺步骤的位置及内容: .
(4)在实验中,未进行操作④,所配溶液的浓度会 (填“偏高”、“偏低”或“无影响”,下同);定容时俯视液面,所配溶液的浓度会偏高.称量时已观察到NaOH吸水,所配溶液的浓度会 .
查看答案和解析>>
科目:高中化学 来源: 题型:
对Na、Mg、Al的有关性质的叙述正确的是( )
|
| A. | 碱性:NaOH<Mg(OH)2<Al(OH)3 | B. | 第一电离能:Na<Mg<Al |
|
| C. | 电负性:Na>Mg>Al | D. | 还原性:Na>Mg>Al |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com