
【题目】以干海带为原料提取碘单质和氯化钾的过程主要分三步:完成下列填空:
(1)步骤一:灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质。实验室灼烧海带应放在____(填写仪器名称)中加热,选用热水而不是冷水浸泡海带灰的目的是____。
(2)步骤二:原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I-,制得富碘溶液。实验室模拟氧化过程的实验装置如图所示。
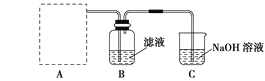
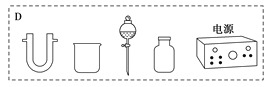
装置中A部分用于制取氯气,实验室制取氯气通常有两种方案:一是在强酸性条件下用氧化剂氧化Cl-;二是电解法。限用图D中的仪器(支撑仪器、导管、导线、石墨棒和橡皮塞除外),能实现的反应是___(选填编号)。
a.2NaCl(s)+MnO2+2H2SO4(浓)![]() MnSO4+Cl2↑+Na2SO4+2H2O
MnSO4+Cl2↑+Na2SO4+2H2O
b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O
c.2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
d.4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
广口瓶B中发生反应的离子方程式是____。装置C中NaOH的作用是___。
(3)步骤三:取100 mL B中富碘溶液,按如下流程分离碘单质。
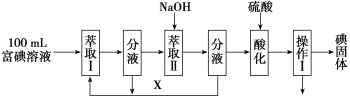
萃取Ⅱ和酸化过程发生的离子反应方程式分别是:
3I2+6OH-=5I-+IO3-+3H2O;____;
萃取剂X应选择____(选填编号)。
a.100mL苯 b.10mL乙醇 c.10 mLCCl4 d.10mL己烯
实验室进行萃取操作的仪器是_____。操作Ⅰ的名称是___。
(4)分离出的KCl样品中常含有少量NaCl和K2CO3等物质,设计实验用沉淀法测定氯化钾样品中K2CO3的质量分数:①要用到的化学试剂是___(填写化学式);②要测定的物理量是_____。
【答案】坩埚 加快溶解速率 bc Cl2+2I-=I2+2Cl- 吸收未反应的氯气,防止污染 5I-+IO3-+6H+=3I2+3H2O c 分液漏斗 过滤 BaCl2或CaCl2 样品质量和干燥沉淀质量
【解析】
(1)灼烧固体应选择坩埚来加热灼烧,温度升高物质溶解度增大,热水能加快物质溶解的速度;
(2)氯气制备:方法一,是在强酸性条件下用氧化剂氧化Cl-,实现该反应是常温下发生的氧化还原反应,据此选择实现此条件下的反应,方法二,是电解法,限用图D中的仪器是电解饱和食盐水得到氯气,原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I-,制得富碘溶液,过量的氯气不能直接排放到空气中,用装置C中氢氧化钠溶液吸收避免污染;
(3)向萃取II溶液中加入NaOH溶液,溶液中先发生歧化反应产生I-、IO3-,然后在酸性条件下,这两种离子再反应变为I2,萃取是一种常用的分离液-液混合物的方法,它是利用溶质在互不相溶的溶剂里溶解度的不同(溶质在萃取剂中的溶解度要大于在原溶剂中的溶解度),用一种溶剂把溶质从它与另一溶剂所组成的溶液里提取出来的操作,分液是把互不相溶的两种液体分开的操作,一般分液都是与萃取配合使用的;操作Ⅰ后得到碘单质固体,说明操作Ⅰ为过滤;
(4)氯化钾样品中含K2CO3,测定K2CO3的质量分数,需要加入试剂沉淀碳酸根离子且不引入新的杂质,测定样品质量和生成沉淀质量,依据元素守恒计算碳酸钾的质量分数。
(1)灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质。实验室灼烧海带应放在坩埚中加热,选用热水而不是冷水浸泡海带灰的目的是加快溶解速率;
(2)氯气制备方法:方法一是在强酸性条件下用氧化剂氧化Cl-,实现该反应是常温下发生的氧化还原反应,据此选择实现此条件下的反应;方法二是电解法,限用图D中的仪器是电解饱和食盐水得到氯气。
a.2NaCl(s)+MnO2+2H2SO4(浓)![]() MnSO4+Cl2↑+Na2SO4+2H2O,反应需要加热,a错误;b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O,此反应不需要加热常温下发生反应生成氯气,b正确;
MnSO4+Cl2↑+Na2SO4+2H2O,反应需要加热,a错误;b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O,此反应不需要加热常温下发生反应生成氯气,b正确;
c.2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,反应是通电电解氯化钠溶液,是利用氯碱工业原理,c正确;
2NaOH+Cl2↑+H2↑,反应是通电电解氯化钠溶液,是利用氯碱工业原理,c正确;
d.4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O,反应需要加热反应,d错误;
MnCl2+Cl2↑+2H2O,反应需要加热反应,d错误;
故合理选项是bc;
原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I-,制得富碘溶液,广口瓶B中是发生反应的离子方程式是 Cl2+2I-=I2+2Cl-,过量的氯气不能直接排放到空气中,用装置C中氢氧化钠溶液吸收,避免污染;
(3)向萃取后的溶液中加入NaOH溶液,先发生歧化反应,产生I-、IO3-,然后酸化,I-、IO3-、H+发生归中反应产生I2,反应方程式为5I-+IO3-+6H+=3I2+3H2O,萃取剂X应选择不溶于水的有机溶剂且碘单质在其中溶解性大,
a.苯不溶于水,碘单质在苯中溶解性大,但100mL苯的体积和溶液体积相同,萃取碘单质后浓度小,试剂浪费,a错误;
b.10mL乙醇和水溶液混溶,不能分层,不能做萃取剂,b错误;
c.10mLCCl4 和水溶液不溶,能分层且碘单质在其中溶解性大,可以作萃取剂, c正确; d.10mL己烯和碘单质发生加成反应,不能做萃取剂,d错误;
故合理选项是c;
实验室进行萃取操作需要的仪器是分液漏斗,操作Ⅰ后得到碘单质固体,说明操作Ⅰ为过滤;
(4)用沉淀法测定氯化钾样品中K2CO3的质量分数,称量一定质量的样品,在烧杯中溶解,加入过量BaCl2或CaCl2溶液,沉淀CO32-离子生成沉淀,过滤得到沉淀,洗涤、干燥,称量沉淀质量,计算沉淀物质的量,结合碳元素守恒,计算出碳酸钾质量,进而得到碳酸钾的质量分数。故①要用到物质的化学试剂是BaCl2或CaCl2; ②要测定的物理量是需要测定样品质量和干燥沉淀质量。


 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的数目是
①12.0g熔融的NaHSO4中含有的阳离子数为0.2NA
②1mol Na2O 和Na2O2混合物中含有的阴、阴离子总数是3NA
③常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
④7.8g![]() 中含有的碳碳双键数目为0.3NA
中含有的碳碳双键数目为0.3NA
⑤用1L1.0 mol/LFeCl3溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为NA
⑥1mol SO2与足量O2在一定条件下充分反应生成SO3,共转移2NA个电子
⑦在反应KIO3+6HI=KI+3I2 +3H2O 中,每生成3molI2转移的电子数为5NA
⑧常温常压下,17 g甲基(-14CH3)中所含的中子数为9NA
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃即开始升华。
(1)氯化铝是________________(填“离子化合物”或“共价化合物”)。
(2)在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92g·L-1,且已知它的结构中有配位键(当共价键中共用的电子对是由其中一原子独自供应,另一原子提供空轨道时,就形成配位键)。配位键形成后,就与一般共价键无异,氯化铝的化学式为________,结构式为________。
(3)无水氯化铝在空气中强烈地“发烟”,其原因是______________________。
(4)设计一个更可靠的实验,判别氯化铝是离子化合物还是共价化合物。你设计的实验是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙醇为原料,用下述6种类型的反应:①氧化,②消去,③加成,④酯化,⑤水解,⑥加聚,来合成乙二酸乙二酯(![]() )的正确顺序是( )
)的正确顺序是( )
A. ①⑤②③④B. ①②③④⑤
C. ②③⑤①⑥D. ②③⑤①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.在标况下1mol N2的体积为22.4L/mol
B.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
C.1L一氧化碳气体一定比1L氧气的质量小
D.常温常压下,8g O3中含有8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示小麦开花数天后测定种子中主要物质的变化,请据图回答下列问题:
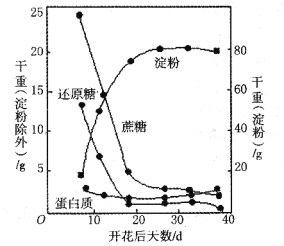
(1)成熟小麦种子中主要的营养物质是________。
(2)检测还原糖的试剂是________,还原糖的多少可通过________来判断。
(3)小麦种子成熟过程中,胚乳里蔗糖与还原糖含量比较,两者的变化趋势________________(填“相同”或“不同”)。
(4)种子成熟时,淀粉的形成与一种磷酸化酶的活性有密切关系,为验证磷酸化酶是否是蛋白质,实验过程中实验组试管加入________,对照组试管中加入2 mL豆浆,然后加入等量的________,如果均出现________现象,则证明磷酸化酶是蛋白质。
(5)播种等量的小麦种子和花生种子,________种子需要浅播,因为该种子中_______化合物含量多,该化合物元素组成特点是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需纯净的NaCl晶体,但现有的NaCl晶体中混有少量的Na2SO4和NH4HCO3,为除去杂质,甲同学设计了如下实验:(已知NH4HCO3 ![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
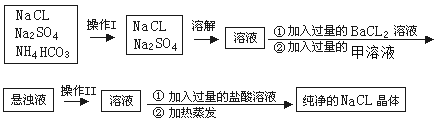
(1)上述操作I、II的名称分别为______、_______
(2)进行操作“加入过量的BaCl2溶液”时,如何判断BaCl2溶液已过量,其方法是______________________________________________________
(3)操作“加入过量的甲溶液”,甲溶液为______溶液,此操作的目的是________________________。
(4)操作“加入过量的盐酸溶液”的目的是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A的相对分子质量(分子量)大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
(1)该化合物分子中含有___________个氧原子。
(2)该化合物的分子式为____________。
(3)该化合物分子中最多含______个碳氧双键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
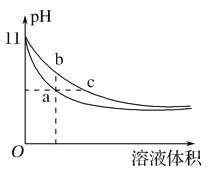
A. a点导电能力比b点强
B. b点的Kw值大于c点
C. 与盐酸完全反应时,消耗盐酸体积Va>Vc
D. a、c两点的c(H+)相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com