
【题目】酸牛奶中的乳酸可增进食欲、促进胃液分泌、增强肠胃的消化功能,对人体具有保健作用,乳酸分子的结构简式为![]() 。工业上可由乙烯来合成乳酸,方法如下:
。工业上可由乙烯来合成乳酸,方法如下:
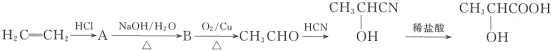
(1)乳酸所含的官能团的名称是______。
(2)写出下列物质转化的化学方程式:
①A→B______。
②![]() __________。
__________。
(3)A在一定条件下可发生消去反应,写出其发生消去反应的化学方程式:____。
【答案】羟基、羧基 CH3CH2Cl+NaOH![]() CH3CH2OH+NaCl
CH3CH2OH+NaCl ![]() +2H2O+HCl
+2H2O+HCl![]() +NH4Cl CH3CH2Cl+NaOH
+NH4Cl CH3CH2Cl+NaOH![]() CH2=CH2↑+NaCl+H2O
CH2=CH2↑+NaCl+H2O
【解析】
由转化关系可知A为CH3CH2Cl,B为CH3CH2OH。
(1)乳酸的结构为:![]() ,含有羧基和羟基;
,含有羧基和羟基;
(2)①A→B的反应为CH3CH2Cl在碱性条件下的水解,方程式为CH3CH2Cl+NaOH![]() CH3CH2OH+NaCl;
CH3CH2OH+NaCl;
②![]() ,
,![]() 是在稀盐酸作用下生成,反应的化学方程式为
是在稀盐酸作用下生成,反应的化学方程式为![]() +2H2O+HCl
+2H2O+HCl![]()
![]() +NH4Cl;
+NH4Cl;
(3)A为CH3CH2Cl,在一定条件下可发生消去反应生成乙烯,反应的方程式为CH3CH2Cl+NaOH![]() CH2=CH2↑+NaCl+H2O。
CH2=CH2↑+NaCl+H2O。


科目:高中化学 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统,放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是( )
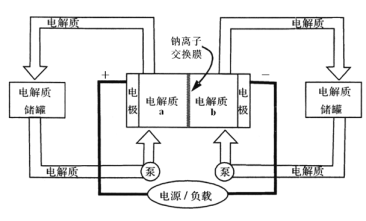
A. 放电时,负极反应为3NaBr-2e-=NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e-=Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24 L H2时,b池生成17.40gNa2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一条鱼、虾绝迹的小河边有四座工厂甲、乙、丙、丁(如图),它们排出的废液里,每个工厂只有 Na2CO3、CuCl2、Ca(OH)2、HCl 中的一种。某中学环保小组对河水监测时发现:① 甲处河水澄清且呈蓝色;② 乙处河水由乳白色浑浊变浅蓝色浑浊;③ 丙处河水由浑变清;④ 丁处产生气泡,河水仍清,请推断:
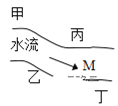
(1)四座工厂排除的废液里含有的污染物:甲_______,乙________,丙_______,丁________。
(2)在M处取出的河水中,肯定含有的离子是____________________。
(3)写出丙厂处可能发生的离子方程式______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘的工业生产过程如下:

下列说法不正确的是 ( )
A.试剂X可以为NaOH溶液,其作用是使浸泡液中的可溶性有机物形成沉淀
B.氧化剂可以用H2O2或适量的Cl2
C.干海带浸泡液中的碘离子可用淀粉溶液检验
D.氧化后的滤液在实验室也可采用四氯化碳萃取、分液、蒸馏的方法得到粗碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是
A.所占的体积由大到小的顺序是:H2>CH4>O2>CO2>SO2
B.所含分子数由多到少的顺序是:H2>CH4>O2>CO2>SO2
C.所含的电子数由多到少的顺序是:SO2>CO2>O2>CH4>H2
D.密度由大到小的顺序是:SO2>CO2>O2>CH4>H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1 mol/L的是
A.将40g NaOH溶解于1L水中配成的溶液
B.将80gSO3溶于水配成1L溶液(已知,SO3+H2O=H2SO4)
C.将0.5mol/L的NaNO3溶液100mL加热蒸发掉50g水后的溶液
D.含K+为2mol的K2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、D、E、W是中学常见的四种元素,原子序数依次增大,A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺W会导致贫血症状。
(1)写出AE4的电子式:____________________。
(2)下列事实能用元素周期律解释的是(填字母序号)___________。
a.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b.E的气态氢化物的稳定性小于HF
c.WE3的溶液可用于刻蚀铜制的印刷电路板
(3)NaCN是一种有剧毒的盐,用E的一种氧化物EO2可以除去水溶液中含有的该有毒物质,得到一种生活中常见的固体和两种无毒气体。写出该反应的离子方程式:_________________________________________。
(4)工业上用电解法制备D的单质,反应的化学方程式为_____________________。
(5)W的单质可用于处理酸性废水中的NO3-,使其转换为NH4+,同时生成有磁性的W的氧化物X,再进行后续处理。
①上述反应的离子方程式为___________________________________________。
②D的单质与X在高温下反应的化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列叙述错误的是
A.向0.1 mol·L-1的醋酸溶液中加水或通入HCl气体都能使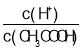 值增大
值增大
B.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
C.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7
D.0.1 mol·L-1某一元酸HA溶液中![]() =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol·L-1
=1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1。下列有关说法正确的是
2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1。下列有关说法正确的是
①用A表示的反应速率是0.4 mol·L-1·min-1
②在2 min末时,反应物B的反应速率是0.3 mol·L-1·min-1
③在这2 min内用C表示的平均速率为0.2 mol·L-1·min-1
④在2 min时,B、C、D的浓度比一定为3∶2∶1
⑤若D的起始浓度为0.1 mol·L-1,则2 min时D的浓度为0.3 mol·L-1
A. ①②③B. ②④C. ④⑤D. ③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com