
A、 |
B、 |
C、 |
D、 |
| 6.72L |
| 22.4L/mol |
| 6.72L |
| 22.4L/mol |
|


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
| A、①<②<③ |
| B、②<①<③ |
| C、①<③<② |
| D、③<①<② |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三种分散系的分散质均能通过滤纸 |
| B、胶体在一定的条件下也能稳定存在 |
| C、溶液和胶体通常都是无色透明的液体,而浊液不透明 |
| D、胶体区别于其他分散系的本质特征是产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4℃时,5.4mL水中所含的水分子数是0.3NA(4℃时,水的密度为1.0g/ml) |
| B、在常温常压下,11.2L氯气所含的原子数为NA |
| C、标准状况下,22.4L氢气所含的质子数为2 NA |
| D、2L 1mol?L-1K2SO4溶液中离子的总数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与普通碳原子的化学性质不同 |
| B、与14N含的中子数相同 |
| C、是金刚石的同素异形体 |
| D、与12C互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | SO42- | NO3- |
| 浓度/mol?L-1 | 2×10-6 | 3×10-6 | 2×10-5 | 1.5×10-5 |
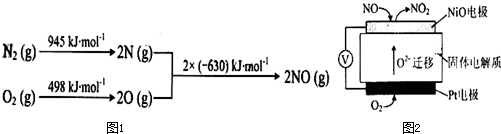
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(NO) |
| n(CO) |
| n(NO) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.5 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.1 mol?L-1 |
| D、0.9 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com