
| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| C. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| D. | pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ |
分析 A.硫化氢是二元弱酸分步电离;
B.氨水溶液中一水合氨是弱碱存在电离平衡,稀释促进电离;
C.溶液中存在物料守恒,n(Na)=n(C2O42-);
D.对应酸的酸性越弱,其盐的水解程度越大,溶液的碱性越强,溶液PH越大;当PH相同时,酸越强,盐的浓度越大;
解答 解:A.pH=5的H2S溶液中存在电离平衡,H2S?H++HS-,HS-?H++S2-,c(H+)=1×10-5 mol•L-1>c(HS-),故A错误;
B.氨水溶液中一水合氨是弱碱存在电离平衡,稀释促进电离pH=a的氨水溶液,稀释10倍后,其pH=b,则b>a+1,故B错误;
C.含等物质的量的NaHC2O4和Na2C2O4的溶液中存在物料守恒:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],故C错误;
D.在相同的条件下测得①CH3COONa②NaHCO3 ③NaClO三种溶液pH相同,已知酸性:CH3COOH>HClO>HCO3-,所以水解程度:NaClO>NaHCO3>CH3COONa,pH相同时,溶液的浓度:NaClO<NaHCO3<CH3COONa,即c(Na+):①>②>③,故D正确;
故选D.
点评 本题考查了弱电解质电离平衡,盐类水解原理,电解质溶液中电荷守恒、物料守恒的分析,掌握原理和比较方法是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液中有杂质Na2SO4(氯化钡) | B. | FeS04溶液中有杂质CuSO4(铁粉) | ||
| C. | 生石灰中混有少量石灰石(盐酸) | D. | BaCl2溶液中有少量MgCl2(氢氧化钡) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 | |
| B. | 氯气易液化,液氯可以保存在钢瓶中 | |
| C. | 氯水、氯气、液氯均能与硝酸银溶液反应产生白色沉淀 | |
| D. | 过量的铁在氯气中燃烧生成FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
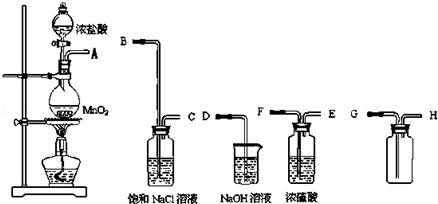
| A. | 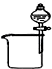 分离碘和酒精 | B. | 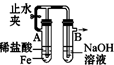 较长时间观察Fe (OH)2白色沉淀 | ||
| C. | 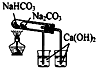 验证NaHCO3和Na2CO3的热稳定性 | D. | 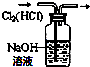 除去Cl2中HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3、H2O、Al(OH)3、NH3•H2O、NaAlO2 | B. | Al(OH)3、NH3、H2O、Fe(OH)3、NaAlO2、H2O | ||
| C. | H2O、Fe(OH)3、Al(OH)3、NH3•H2O、NaAlO2 | D. | H2O、Fe(OH)3、Al(OH)3、NaAlO2、NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg和Al | B. | Mg和Ag | C. | Na和Zn | D. | Fe和Zn |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com