
【题目】中学常见物质A,B,C,D,E,X,存在下图转化关系 (部分生成物和反应条件略去).下列推断不正确的是( ) ![]()
A.若D是一种强碱,则A,B,C均可与X反应生成D
B.若D为NaCl,且A可与C反应生成B,则E可能是CO2
C.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
【答案】C
【解析】解:A.若D是一种强碱,A为Na、E为氧气、B为氧化钠、C为过氧化钠、X为水、D为氢氧化钠,符合转化关系,Na、氧化钠、过氧化钠都能与水反应,故A正确;B.若D为NaCl,A为氢氧化钠、E为二氧化碳、B为碳酸钠、C为碳酸氢钠、X为盐酸,符合转化关系,故B正确;
C.若D是一种白色沉淀,在空气中最终变为红褐色说明D为Fe(OH)2 , X为NaOH,C为Fe2+ , B为Fe3+ , A为Cl2 , E为Fe,才能实现转化关系,故C错误;
D.若D是一种强酸,如为硝酸,则A为氮气或氨气,B为NO,C为NO2 , E为O2 , X为H2O,稀硝酸与铜反应生成NO,浓硝酸与铜反应生成NO2 , 故D正确.
故选C.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】某研究小组向某2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)D(g)+E(g)△H=QkJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的物质的量如下表:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T1℃时,该反应的平衡常数K=;
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是(填字母编号).
a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2molB、0.1molD,0.1molE
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为如图中的(填序号) 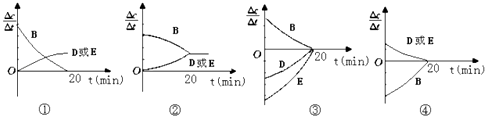
(4)维持容器的体积和温度T1不变,当向该容器中加入1.60molB,0.20molD,0.20molE和nmolA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n取值范围mol.
(5)维持容器的体积和温度T1不变,各物质的起始物质的量为:n(A)=1.0mol,n(B)=3.0mol,n(D)=amol,n(E)=0mol,达到平衡后,n(E)=0.50mol,则a= .
(6)若该密闭容器绝热,实验测得B的转化率B%随时间变化的示意图如图所示由图可知,Q0(填“大于”或“小于”),c点v正v逆(填“大于”、“小于”或“等于”.) 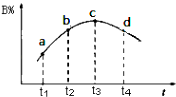
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:mA(气)+nB(气)pC(气)(焓变为△H),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如图1,2所示,下列结论正确的是( ) 
A.m+n>p,△H>0
B.m+n>p,△H<0
C.m+n<p,△H>0
D.m+n<p,△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)某温度下,纯水中的c(H+)=2.0×10﹣7mol/L,此时溶液的c(OH﹣)=mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10﹣4mol/L,则溶液中,由水电离产生的c(H+)=mol/L,此时温度25℃(填“高于”、“低于”或“等于”).
(2)某温度下的水溶液中,C (H+)=10x mol/L,C (OH﹣)=10y mol/L,x和y的关系如图所示.计算:该温度下水的离子积为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国空气质量预报的内容主要包括三个方面:二氧化硫、氮氧化物(NOx)、悬浮颗粒物等三种大气污染物的浓度.
(1)①与氮氧化物有关的全球或区域性大气环境问题有(填字母序号).
a.酸雨 b.沙尘暴 c.光化学烟雾 d.温室效应
②悬浮颗粒物可用高压电除尘,是利用了现象
(2)为了降低汽车尾气对大气的污染,目前最有效的方法是给汽车安装尾气净化装置.它能将尾气中的一氧化碳和NO在催化剂作用下,发生反应转化为无害气体,其反应的化学方程式为 .
(3)①写出实验室中由固体物质制取氨气的化学方程式;
②欲收集一瓶干燥的氨气,选择图1中的装置,其连接顺序为:发生装置→(按气流方向,用小写字母表示)
③实验室也可用图2所示装置制取氨气.烧瓶内固体可选用(选填选项的代号).
a.碱石灰 b.生石灰 c.二氧化硅 d.五氧化二磷
④催化剂存在下,NH3也可用来消除NOx的污染,生成两种对环境无害的物质,请写出NH3与NO2反应的化学方程式为 , 该反应中每生成0.5molN2转移 mol电子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A. 铝片与稀硫酸的反应 B. Ba(OH)2·8H2O与NH4Cl的反应
C. 灼热的碳与二氧化碳的反应 D. 甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图1为两套实验装置.
(1)写出下列仪器的名称:① , ④ .
(2)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有 , 冷凝管的进水口是
(填“f”或“g”);
(3)某校环保兴趣小组在处理污水样品时,需用质量分数为37%、密度为1.19g/cm3的浓盐酸配制成250mL 0.1molL﹣1的稀盐酸溶液.装置Ⅱ是某同学转移溶液的示意图,图Ⅱ中的错误是 .
①盛放浓盐酸溶液的试剂瓶标签上应印有下列如图2警示标记中的 .
②在如图3所示仪器中,配制上述溶液不需要的是(填如图相应仪器的序号);
③根据计算,本实验需要量取浓盐酸的体积为mL,本实验量筒应使用的是(在横线上填写相应的序号,否则无分,下同)
A.10mL B.100mL C.250mL D.500mL
④在容量瓶的使用方法中,下列操作正确的是 .
A.使用容量瓶前检查它是否漏水
B.容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加水至接近刻度线1﹣2cm处,用胶头滴管加蒸馏水至刻度线
E、盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
⑤若定容后摇匀静置,发现凹液面低于刻度线,此时应该 .
A.直接转移到细口试剂瓶中 B.再用胶头滴管加水,重新定容
C.将此溶液倒掉,重新配制 D.直接贮存于容量瓶中
⑥假设配制时其他操作均正确,只出现以下某一情况,试判断所配制的溶液浓度相比于要求的值(即0.1mol/L)如何.(a、偏高;b、偏低;c、无影响,在下列横线上填相应序号)
A.容量瓶中有少量蒸馏水
B.稀释浓HCl时,没有冷却就立即转移到容量瓶中
C.配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中
D.若定容时俯视,所配溶液的物质的量浓度 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z,W有如图所示的转化关系,则X,Y可能是( )
①C,CO②AlCl3、Al(OH)3③Fe、Fe(NO3)2④Na2CO3、NaHCO3 . 
A.①②③④
B.①②
C.③④
D.①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com