
| A. | 中和热一定是强酸跟强碱反应放出的热量 | |
| B. | 1 mol酸与1 mol碱完全反应放出的热量是中和热 | |
| C. | 在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热 | |
| D. | 表示中和热的离子方程式为:H+(aq)+OH-(aq)=H2O(l)△H=57.3KJ/mol |
分析 A.测定中和热,选择的为稀的强酸与强碱,浓硫酸稀释放热;
B.弱酸或弱碱的电离吸热,且中和热中生成1mol水;
C.中和热为稀溶液中酸与碱发生中和反应生成1 mol H2O(l)时的反应热;
D.中和反应放出热量.
解答 解:A.中和热是稀的酸与碱反应生成1mol水放出的热量,故A错误;
B.1 mol酸与1 mol碱完全反应可能生成2mol水,且酸、碱不一定为强电解质,则放出的热量不一定为中和热,故B错误;
C.在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热,故C正确;
D.表示中和热的离子方程式为H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、中和热的判断及测定为解答的关键,侧重分析与应用能力的考查,注意中和热概念的要点,题目难度不大.


科目:高中化学 来源: 题型:推断题
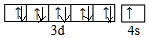 .
.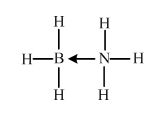 (必须标明配位键).
(必须标明配位键).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某实验小组用如图装置制备家用消毒液,并探究其性质.
某实验小组用如图装置制备家用消毒液,并探究其性质.| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
| 操作 | 现象 |
| 取5mLpH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)=SO2(g)+Q3 Q3>297.16 kJ | |
| B. | 单斜硫和正交硫互为同分异构体 | |
| C. | 常温下单斜硫比正交硫稳定 | |
| D. | 单斜硫转化为正交硫的反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
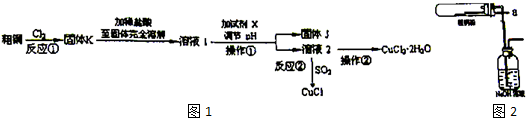
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用C表示该反应的速率为0.03mol/(L•s) | |
| B. | 达到平衡,测得放出热量为x kJ,则x=Q | |
| C. | 若向容器中再充入1 mol C,重新达到平衡,A的体积分数保持不变 | |
| D. | 若升高温度,则V(逆)增大,V(正)减小,平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
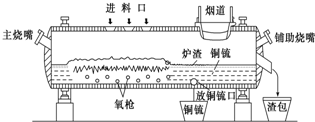
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X属于非金属元素 | B. | 对应的氢化物的热稳定性:W>Y | ||
| C. | W与Z易于形成离子化合物 | D. | Z离子的氧化性强于X离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com