
分析 NaHCO3、NaHS、Na2HPO4等溶液显碱性,其酸式酸根离子的电离程度小于水解程度,导致酸根离子浓度小于酸浓度,据此分析解答.
解答 解:NaHCO3、NaHS、Na2HPO4等溶液显碱性,其酸式酸根离子的电离程度小于水解程度,导致酸根离子浓度小于酸浓度,但其浓度都较小,所以存在[CO32-]<[H2CO3],[S2-]<[H2S],[PO43-]<[H2PO4-],
故答案为:<;<;<.
点评 本题考查离子浓度大小比较,正确获取题给信息并利用信息是解本题关键,注意弱酸酸式酸根离子水解程度和电离程度都较小,多元弱酸第一步水解程度大于第二步水解程度,根据溶液酸碱性判断酸式酸根离子水解程度和电离程度相对大小,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 1:3 | C. | 2:3 | D. | 3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(NO3)3溶液 | B. | FeCl2溶液 | C. | BaCl2溶液 | D. | FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃20mL3 mol•L-1的X溶液 | B. | 20℃30 mL 2 mol•L-1的X溶液 | ||
| C. | 20℃10 mL 4 mol•L-1的X溶液 | D. | 10℃10 mL 2 mol•L-1的X溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由反应①知CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574 kJ•mol-1 | |
| B. | 反应①②转移的电子数相同 | |
| C. | 0.2 mol CH4还原NO2至N2,放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为1.60 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界存在大量硅单质 | |
| B. | 自然界的硅易开采,且可再生 | |
| C. | 硅燃料便于运输、贮存,从安全角度考虑,硅是优质燃料 | |
| D. | 硅燃料燃烧放出的热量多,其燃烧产物对环境的污染容易有效地控制 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
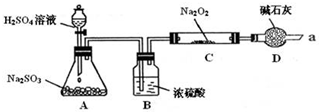

| 实验步骤 | 现象 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解. | 固体全部溶解 |
| ②向上试管中加入过量的稀盐酸,将产生的气体通入少量酸性KMnO4溶液中. | KMnO4溶液紫色褪去 |
| ③向步骤②反应后的试管中,加入适量的BaCl2溶液. | 产生白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com