
下列离子反应方程式错误的是
A.向Na2SiO3溶液中逐滴加入少量稀盐酸:SiO32-+ 2H+=H2SiO3(胶体)
B.稀Fe(NO3)2溶液中加入稀盐酸:Fe2++4H++NO3-= Fe3++NO↑+2H2O
C.将Cu片加入稀硝酸中:3Cu + 8H++2NO3-=3Cu2+ +2NO↑+ 4H2O
D.向NH4Al(SO4)2溶液中加入过量的Ba(OH)2稀溶液:NH4+ + Al3+ + 2SO42- + 2Ba2+ + 5OH-=2BaSO4↓+ NH3·H2O + AlO2-+ 2H2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015广东省揭阳市高一下学期第一次阶段考试理化学试卷(解析版) 题型:选择题
1919年,科学家第一次实现了人类多年的梦想——人工转变元素。这个核反应如下:
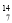 N+
N+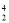 He→
He→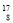 O+
O+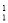 H下列叙述正确的是
H下列叙述正确的是
A.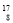 O原子核内有9个质子 B.
O原子核内有9个质子 B.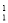 H原子核内有1个中子
H原子核内有1个中子
C.O2和O3互为同位素 D.通常情况下,He和N2化学性质都很稳定
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省佛山市高二下学期第一次月考理化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列说法正确的是
A.标准状况下,11.2 L的丙烷所含的氢原子数为4NA
B.16g甲烷所含电子数目为16NA
C.标准状况下,11.2 L三氯甲烷所含分子数为0.5NA
D.14 g乙烯的原子数为3NA
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省佛山市高二下学期第一次月考理化学试卷(解析版) 题型:选择题
可用分液漏斗分离的一组混合物的是
A.硝基苯和酒精 B.溴苯和溴 C.甲苯和水 D.硝基苯和苯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高三下学期第二次质量检测理综化学试卷(解析版) 题型:选择题
下列溶液或浊液中,关于离子浓度的说法正确的是
A.一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小
B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-) > c(HCO3-),且2c(Na+)=3[c(CO32-)+c(HCO3-)]
C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后:c(CH3COO-) + 2c(OH-) = c(CH3COOH) + 2c(H+)
D.常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河西区高三下学期总复习质量调查一理综化学试卷(解析版) 题型:填空题
(14分)A~I都是由短周期元素组成的常见物质,它们之间的转化关系如下图所示。已知:A为气体,其水溶液呈碱性;D、F均能与人体血液中的血红蛋白结合而使人中毒;E可作为半导体材料。
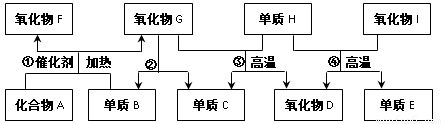
(1)化合物A的电子式为_______________________。
氧化物I中化学键类型:_____________________。
组成E单质的元素在元素周期表中的位置是____________________________。
图中物质所含元素原子的半径由大到小依次是(写元素符号)_____________。
(2)反应④的化学方程式为______________________________________________。
(3)将F与B按体积比2:1混合生成气体M,常温下测定M相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示)___________________。
(4)某容积为V L的试管中充满F气体(标准状况下),若将该气体完全被水吸收,需通入B的物质的量为(写含V的表达式)_______________mol,此时所得溶液中再通入气体A,恰好完全反应后所得溶液中各离子浓度由大到小依次为:_________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高三下学期第一次质量调查化学试卷(解析版) 题型:填空题
(14分)CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
物 质 | CH4 | CO2 | CO | H2 |
平衡浓度(mol·L-1) | 0.5 | 0.5 | 2.0 | 2.0 |
①此温度下,该反应的平衡常数K=__________________(注明单位)。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=a kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H2=b kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3=c kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g)的△H=________kJ·mol-1。
2CO(g)+2H2(g)的△H=________kJ·mol-1。
(2)用Cu2Al2O4做催化剂,发生反应: CO2+CH4  CH3COOH, 请回答:
CH3COOH, 请回答:
①温度与催化剂的催化效率和乙酸的生成速率如图。

250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
②为提高上述反应CH4的转化率,可采取的措施有 (写2种)。
③Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为 ,每消耗3mol Cu2Al2O4时被还原的HNO3为 mol。
(3)Li2O、Na2O、MgO均能吸收CO2,
①若寻找吸收CO2的其他物质,下列建议合理的是 。
a.可在碱性氧化物中寻找
b.可在具有强氧化性的物质中寻找
c.可在ⅠA、ⅡA族元素的氧化物中寻找
②Li4SiO 4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省资阳市高三第三次模拟考试理综化学试卷(解析版) 题型:选择题
常温下,下列各组离子在给定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.Kw=1.01×10-14的某无色溶液:NH4+、K+、AlO2-、Cl-
C.与铝反应产生大量氢气的溶液:Na+、Ba2+、HCO3-、NO3-
D.由水电离出来的c(H+)=1.0×10-13 mol·L-1的溶液:K+、Na+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三第二次联考理综化学试卷(解析版) 题型:填空题
(12分)甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) | K3 | ||
(1)反应②是 (填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。
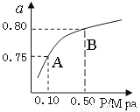
(3)据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正) v(逆) (填“>”“=”或“<”)
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,
已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
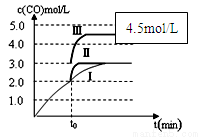
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com