
| A. | 因SiO2不溶于水,故SiO2不是酸性氧化物 | |
| B. | 在反应SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑中SiO2作氧化剂 | |
| C. | SiO2是一种空间立体网状结构的晶体,熔点高、硬度大 | |
| D. | 氢氟酸能够刻蚀玻璃,故不能用玻璃瓶来盛装氢氟酸 |
分析 A.与碱反应只生成盐和水的属于酸性氧化物;
B.依据元素化合价变化判断;
C.依据二氧化硅空间结构及晶体类型解答;
D.氢氟酸与玻璃中的二氧化硅反应.
解答 解:A.二氧化硅能够与氢氧化钠反应生成硅酸钠和水,属于酸性氧化物,故A错误;
B.在反应SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑中,二氧化硅中的硅元素化合价降低,所以SiO2作氧化剂,故B正确;
C.SiO2是由硅原子与氧原子构成的一种空间立体网状结构的原子晶体,其熔点高、硬度大,故C正确;
D.SiO2能与氢氟酸反应,故常用氢氟酸刻蚀玻璃,不能用玻璃瓶盛装氢氟酸,故D正确;
故选:A.
点评 本题考查了元素化合物知识,熟悉硅及二氧化硅的结构、性质是解题关键,注意药品保存的注意问题,题目难度不大.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | a-c=m-n | B. | b-d=m+n | C. | a>b>d>c | D. | b>a>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
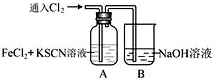 Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色.
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色.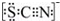 .甲同学猜想SCN-可能被Cl2氧化了,他进行了如下研究;
.甲同学猜想SCN-可能被Cl2氧化了,他进行了如下研究; ,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-;
,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-;| 步骤:分别取等体积、等浓度的含氰废水于甲、乙两支试管中,再分别加入等体积、等浓度的双氧水溶液,只向甲试管中加入少量的无水硫酸铜粉末,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度 | 现象与结论: 若甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用 若两试管中的CN-浓度相同,则Cu2+对双氧水破氰反应不起催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
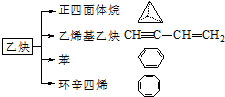 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.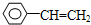 .
.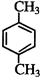 、
、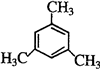 .
. ,试写出有关化学反应方程式:CH≡CH+HCl$→_{△}^{催化剂}$CH2=CHCl,nCH2=CHCl$\stackrel{一定条件}{→}$
,试写出有关化学反应方程式:CH≡CH+HCl$→_{△}^{催化剂}$CH2=CHCl,nCH2=CHCl$\stackrel{一定条件}{→}$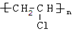 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量酒精在空气中挥发不见了;少量酒精在空气中燃烧后消失 | |
| B. | 块状生石灰在空气中逐渐变成粉末;晶体碳酸钠在空气中逐渐变成粉末 | |
| C. | 木炭燃烧发光、发热;电灯发光、发热 | |
| D. | 石灰水中通入少量CO2后变浑浊;室温下的饱和石灰水加热后变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
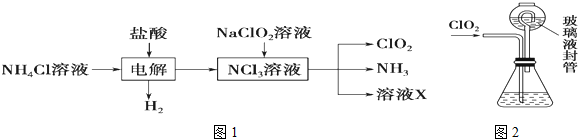
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
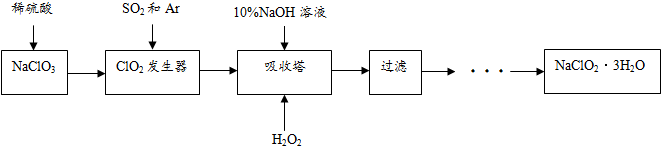
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
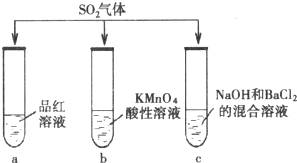 探究SO2的性质.甲组同学将SO2分别通入下列3种溶液中.
探究SO2的性质.甲组同学将SO2分别通入下列3种溶液中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com